4. fejezet A második és harmadik főtétele
Az entrópia (az grech.entropia- fordulat, átalakítás) - a koncepció volt először vtermodinamike hogy meghatározza az intézkedés visszafordíthatatlan energiaelnyelő. Az entrópia vstatisticheskoy fizika - az intézkedés a valószínűsége megvalósítása makroszkopikus állapot, vteorii információk - intézkedés a bizonytalanság kísérlet (teszt), esetleg eltérő eredményeket. Ezek az értelmezések az entrópia egy mély belső kapcsolatot.
1 entrópia. Termodinamikai entrópia értelemben
Lényegében az összes folyamatok nagyrendszerek visszafordíthatatlan.
Felmerül a kérdés: mi az oka lehet visszafordulni? Ez különösen furcsa, ha figyelembe vesszük, hogy minden a mechanika törvényei visszafordítható az időben. És mégis, senki sem látta, például törni egy váza spontán felépült a törmeléket.
A megoldás erre a problémára komplex jött a megnyitása új termodinamikai mennyiség - entrópia - és a nyilvánosságra hozatala csak fizikai értelemben.
A koncepció az entrópia volt először R. Clausius 1862-ben az egyik legcsodálatosabb felfedezések „az a toll hegyét”, azaz elméletileg.
Ennek ellenére és a hiányzó eszközöket, amelyek mérik az entrópia az anyag, ez a koncepció bizonyult rendkívül eredményes.
entrópia

Meg kell figyelni, hogy a jellemzője ennek a képlet. Mint tudjuk,
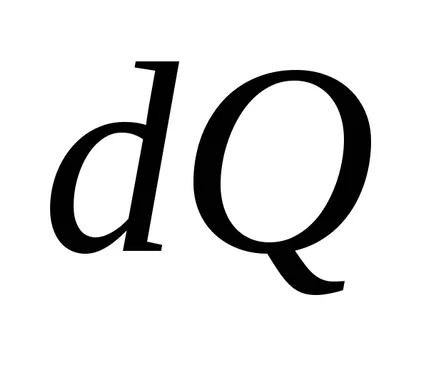


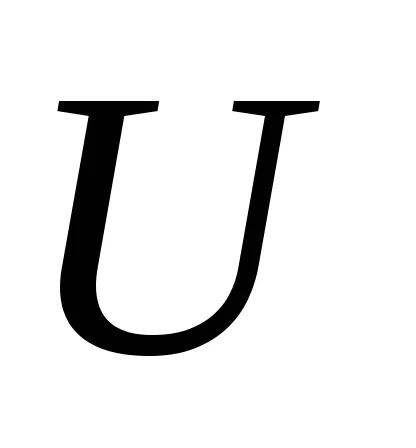
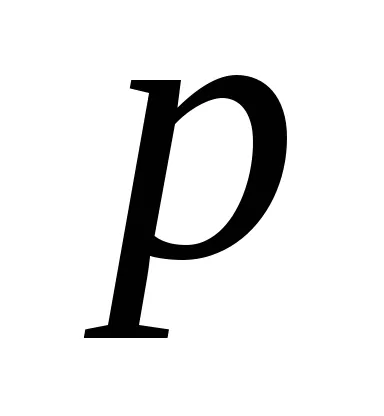


Így, egyensúlyi hőmérsékleten a hőátadó
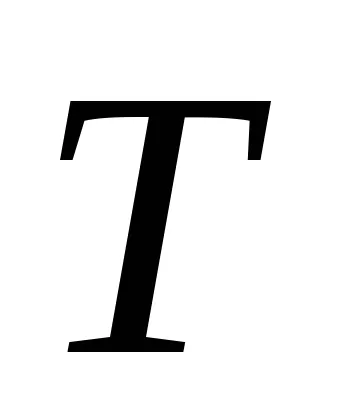
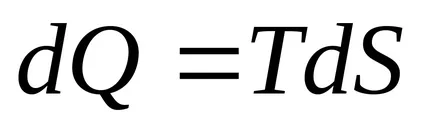
Az első főtétel felírható:
Hagyja, hogy a kezdeti állapotban a test hőmérsékletét
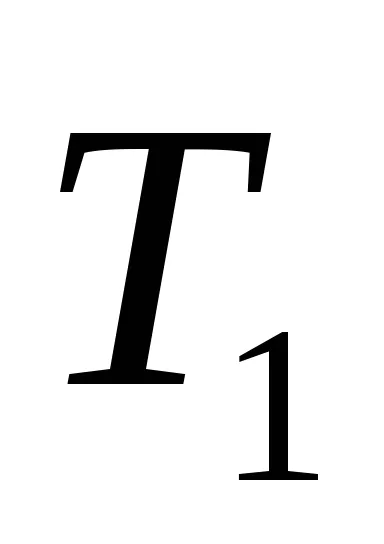
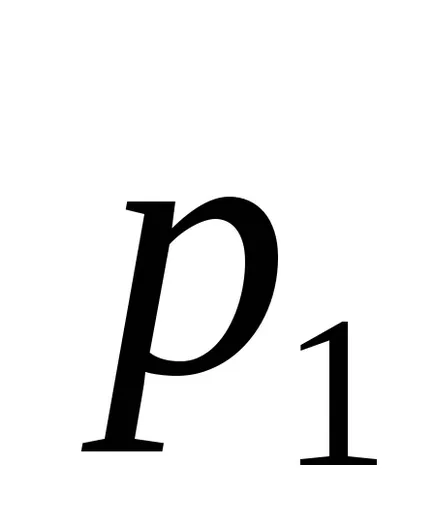
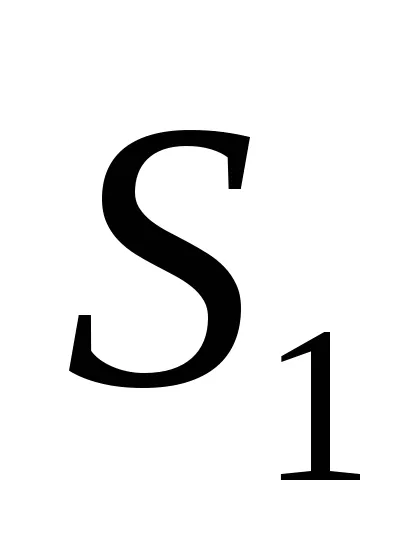
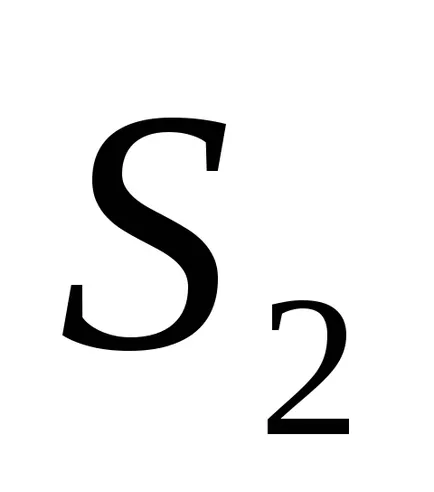
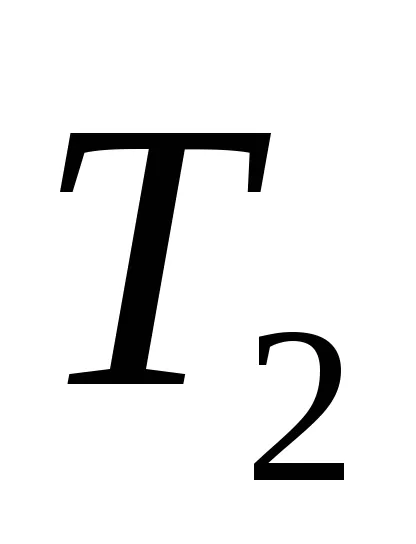
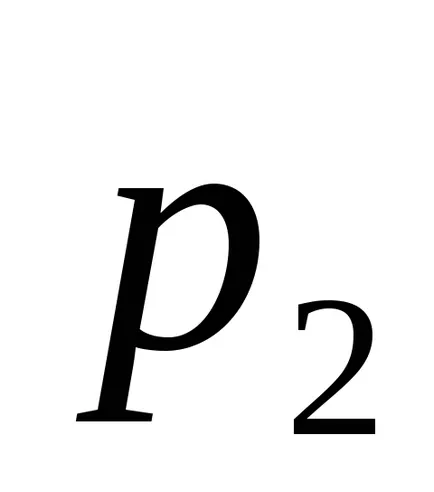
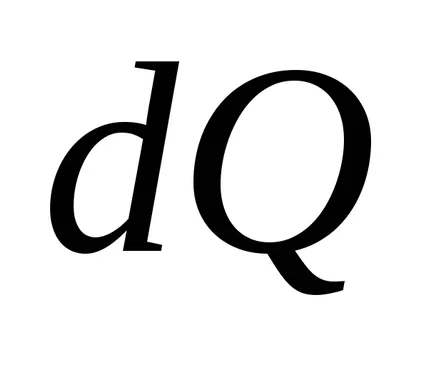
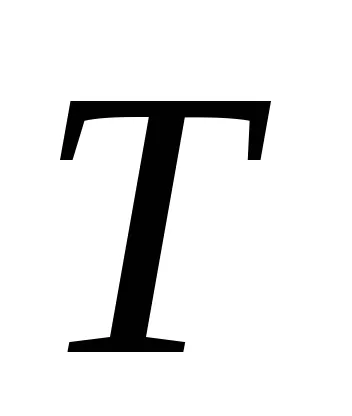
Ekkor az entrópia
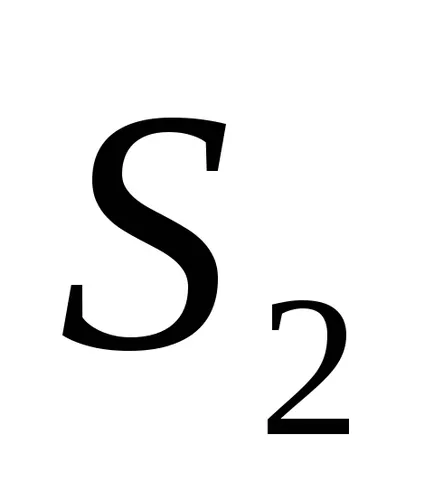
Közelebbről, az izotermikus folyamat (
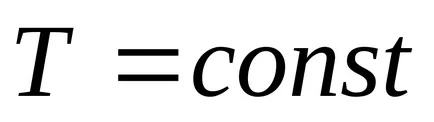
Mivel entrópia egy az állam, az integrál (4.3) nem függ az alakja a görbét, amely a folyamat, de csak az határozza meg a kezdeti és a végső állapot, azaz a határait integráció.
1) Az entrópia - értéke az adalékanyag: az entrópia a rendszer több testület az összege az entrópia az egyes szervek
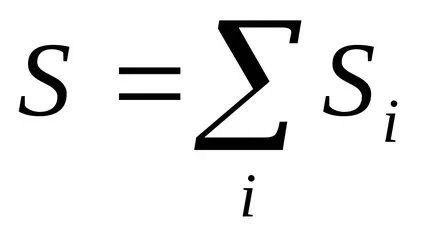
2) Az egyensúlyi folyamatok nélkül hőátadás entrópia nem változik.
Az adiabatikus folyamat
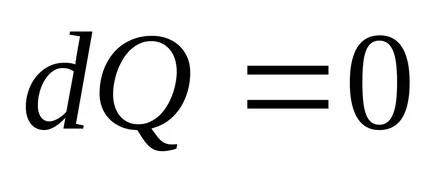
Ezért, az alábbi képlet szerint (4.1) egyensúlyi adiabatikus folyamat
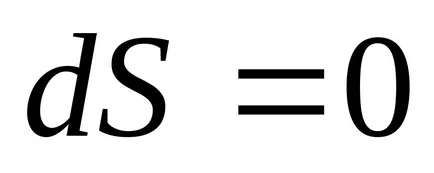
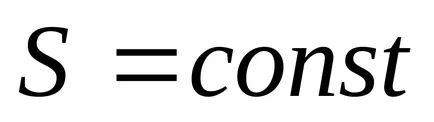
3) állandó térfogaton, az entrópia egy monoton növekvő függvénye a belső energia a test.
Sőt, amikor
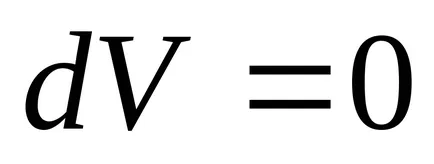
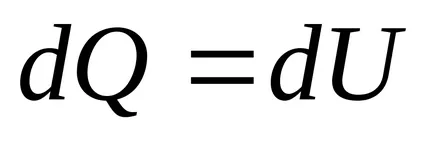
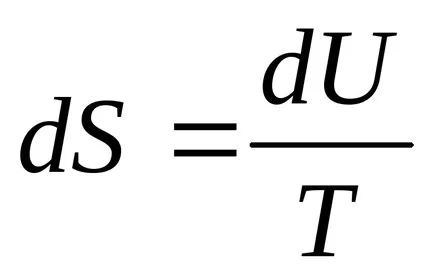
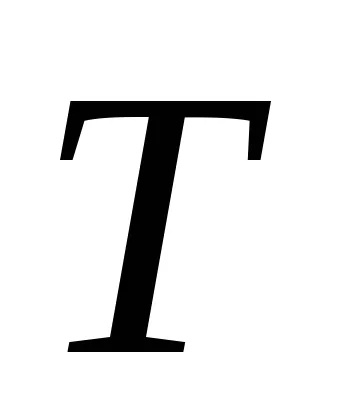
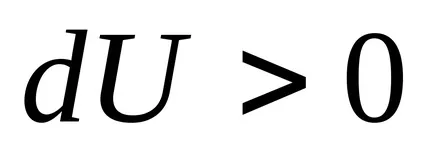
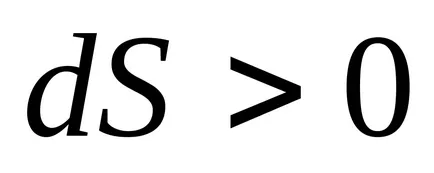
4) Az entrópia meghatározott csak akár egy tetszőleges konstans.
Szerint ugyanis (4.3) ki tudjuk számítani csak a különbség az entrópia

5) belső cél energia, mint a térfogat és entrópia függvényében
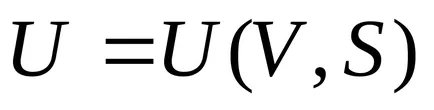
Valóban, a szabály alapján kell különbséget függvényében két változó
.
Figyelembe véve (4.2), amely
,
Ezek az egyenletek határozzák meg a hőmérséklet és a nyomás a belső energia
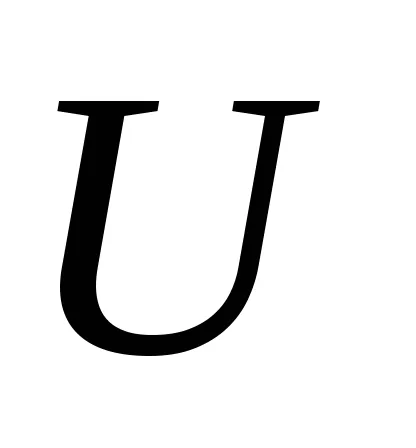
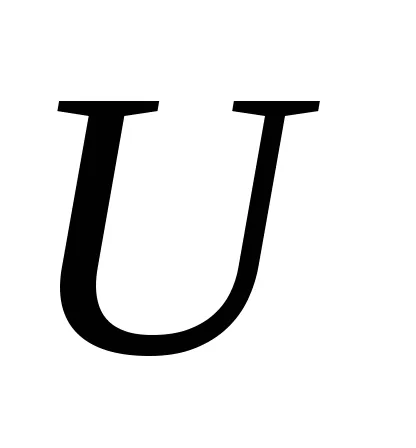
Figyeljük meg, hogy az egyenlő
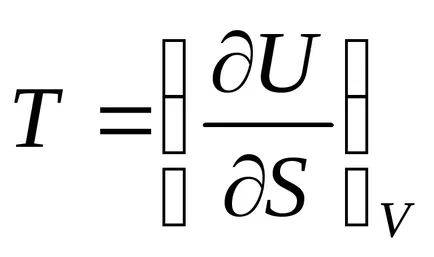
abszolút hőmérséklet