A dehidrogénezési szubsztrát és a hidrogén oxidációját (képződését H2O) mint energiaforrás számára az ATP szintézis
Név: dehidrogénezés szubsztrát és a hidrogén oxidációját (képződését H2O) mint energiaforrás számára az ATP szintézis. NAD és FAD-dependens dehidrogenáz, ubikinon dehidrogenáz, citokróm és a citokróm
Szakterület: Biológia és Genetika
Leírás: Az elektronok, amelyek nagy energiájú potenciállal továbbított csökkentett koenzimek NDH FDH2 és oxigén révén a lánc transzporter lokalizálódik belső membránján mitokondrium. Ezek a reakciót katalizáló típusa: RCHOHR1 ND↔ RCOR1 NDH H. Azonban lehetséges felvétele az elektronok NDPH egy CPE hatására piridin-nukleotid transzhidrogenáz reakcióját katalizálja: NDPH ND NFT NDH. Azáltal FMNsoderzhaschim enzimek tartoznak NDHdegidrogenaza amely szintén lokalizálódik belső membránján mitokondrium; azt.
Fájl mérete: 152,07 KB
Job letöltve: 14 fő.
A dehidrogénezési szubsztrát és a hidrogén oxidációját (képződő H 2 O) mint energiaforrás számára az ATP szintézis. NAD és FAD-dependens dehidrogenáz, ubikinon dehidrogenáz, citokróm és citokróm-oxidáz.
Során felszabaduló energiát az enzimatikus oxidációja metabolitok specifikus dehidrogenáz. A dehidrogénezési reakciók, az elektronok és a protonok át szerves szubsztrátok és koenzimek NAD- FAD-dependens dehidrogenázok. Az elektronok, amelyek nagy energia potenciállal, átvitt csökkentett koenzimek NADH és FADH2 oxigén révén lánc transzporterek lokalizálódik belső membránján mitokondrium. Recovery O2 molekulák jelentkezik eredményeként az elektrontranszfer 4. Mindegyik összekötő az oxigén-2 elektront érkezik hozzá egy láncátvivő szer, felszívódnak a mátrixból 2 proton, ezáltal egy molekula H2O.
Oxidációja szerves anyag a sejtekben kíséri a fogyasztás oxigén és a víz-szintézis, az úgynevezett szöveti légzést. és az elektron transzport lánc (CPE) - légzési lánc.
Az elektronok belépve a CPE, ahogy mozog az egyik hordozóról a másik elveszíti szabad energia. Sok ez az energia formájában tárolt ATP, és részben az energia hőként eltűnt. Továbbá, az elektronok egy nagy energiájú potenciál, ami az oxidációs különböző szubsztrátok lehet használni a reakciókban a bioszintézis amelyre az ATP hozzáadása szükséges redukáló ekvivalensek, mint például a NADPH.
A elektronok átvitelét az oxidált szubsztrátok oxigén több lépésben megy végbe. Az ez magában foglalja a nagyszámú köztes vektorok, melyek mindegyike képes kapcsolódó elektronokat az előző komponens, és továbbítja a következő. Mivel van egy lánc redox reakciók, így a helyreállítási fordulnak elő O2 és H2O-szintézis. A mitokondriális légzési lánc tartalmaz egy nagyszámú hordozóra.
Kivéve ubikinon (KoQ), minden összetevője CPE - fehérjék. Ennek részeként a fehérjék tartalmazhatnak különböző nem proteinszerű komponensek: FMN, Fe a készítményben a vas-kén fehérje, és amely porfirin gyűrűk Cu-ionok.
Elsődleges hidrogén-akceptorok. Elsődleges akceptorok hidrogénatom redox reakció tulajdonított kétféle dehidrogenázok: nikotinamvdzavisimym. koenzimek tartalmazó nikotinsav-származékokra, és flavinzavisimym. tartalmazó származékok riboflavin.
Nikotinamidzavisimye dehidrogenáz tartalmaznak koenzimként NAD +, vagy NADP + (lásd. 2. szakasz). NAD + és a NADP + - származékok PP-vitamin. Ezek a koenzimek része az aktív centrumok dehidrogenázok, de lehet reverzibilisen választható el a komplexet apofermentami és szerepelnek az enzimet a reakció során. Szubsztrátok NAD- és a NADP-függő dehidrogenázok találhatók a mitokondriális mátrixban a citoszolban. Munka része a nikotinamid koenzim nikotinamid.
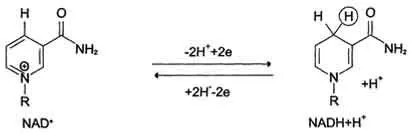
A legtöbb dehidrogenázok ellátó elektronok CPE tartalmaznak NAD +. Ezek katalizálják a típusú reakció:
R - CHOH - R 1 + NAD + ↔ R - CO - R 1 + NADH + H +.
Így, NAD +, kapcsolódó protonok és az elektronok a különböző szubsztrátok, szolgál a fő energiát gyűjtő oxidálható anyagokat és a fő forrása az elektronok, amelyek nagy energia potenciállal rendelkezik, a CPE-t. NADPH nem közvetlen elektron donor a CPE, és szinte kizárólagosan használt regeneratív bioszintézisében. Azonban, a lehetséges felvétele az elektronok a CPE NADPH hatására piridin-nukleotid transzhidrogenáz, katalizálja a reakciót:
NADPH + NAD + ↔ NADP + + NADH.
Flavin dehidrogenáz tartalmaznak koenzimek FAD vagy FMN. Ezek a koenzimek képződnek a szervezetben a B2-vitamin. Flavin koenzimek erősen összefügg apofermentami. Munka része a FAD és FMN izoalloksazinovaya konjugátum gyűrűrendszer.
FAD az elektron akceptor sok szubsztrátumra a reakciókban a típus:
R-CH 2-CH 2-R 1 + E (FAD) ↔ R-CH = CH-R1 + E (FADH2),
ahol E - fehérje része az enzim.
A legtöbb FAD-dependens dehidrogenázok - oldható proteinek lokalizált a mitokondriális mátrixban. Kivételt képez ez alól a szukcinát-dehidrogenáz, található a belső mitokondrium-hártyán. Ahhoz, hogy FMN-tartalmú enzimek tartoznak dehidrogenáz NADH, amely szintén lokalizálódik belső membránján mitokondrium; oxidálódik NADH, amely képződik a mitokondriális mátrixban.
elektron transzport lánc NADH és FADH2, hogy oxigén-átviteli elektronok az NADH-t O 2 számát tartalmazza hordozók, amelyek lokalizálva vannak a belső membrán a mitokondriumok. Kivéve ubikinon és citokróm C, ez az összetett fehérje komplexek.
Dehidrogenáz NADH (NADH-Q-reduktáz komplex I) áll több polipeptid láncok. A szerepe a protézis csoport játszik FMN. Az egyetlen enzim szubsztrát - NADH, 2 ahonnan az elektron és proton transzfer alkotnak a FMN FMNH2. A második proton felszívódik a mátrixból. A reakció a következő egyenlet szerint:
NADH + H + + E (FMN) → NAD + + E (FMNH2)
A FMNH2 elektronok ezután átvisszük egy számos vas-kén fehérje (FES), szerepét játssza a második prosztetikus csoport a molekulában dehidrogenáz NADH. A vas atomok ezen fehérjék (nem-hem vas) vannak összeállítva több csoportban, az úgynevezett vas-kén központok. FeS-központ a számos fehérje (flavoproteinek citokrómok) részt vesz a redox reakciók. Vannak 3 típusú Fes-központok (FES, Fe2S2, Fe4S4), amelyben a vas-atom kapcsolódik egy kénatomhoz egy cisztein maradékot vagy szervetlen kén. NADH dehidrogenáz Fe2S2 tartalmaz többféle központok és Fe4S4 vas atomok ilyen központok, de elfogadja és adományozni elektronok viszont elhaladó ferro- (Fe2 +) és ferri (Fe3 +) állapotban. A vas-kén központok elektronok átkerülnek a koenzim Q (ubikinon).
Rendeltetése ennek a zsírban oldódó kinon származó első betű az angol nevének kinon (kinon), és az ubikinon neve tükrözi azon elterjedt a természetben (mindenütt - mindenütt). Ubikinon molekula a forrástól függően, ahonnan osztják, különböznek lánchossz, amely emlősökben tartalmaz 10 izoprenoid egységek és nevezik Q10. A folyamat a elektron transzfer NADH-dehidrogenáz ubikinonhoz keresztül FeS reverzibilisen átalakítható hidrokinon. Ubiquinon végez kollektor funkciót kapcsolódó elektronokat NADH-dehidrogenáz és más dehidrogenázok flavinzavisimyh különösen a szukcinát-dehidrogenáz. Ubiquinon részt vesz a reakciók a típus:
E (FMNH2) + Q → E (FMN) + QH2.
Citokróm-vagy hemoproteins jelen minden típusú szervezetekre. Eukarióta sejtekben, ezek lokalizáltak a mitokondriális membránok és az ER-ben. Jelenleg mintegy 30 különböző citokrómoknak. Minden citokrómok, mint prosztetikus csoportot tartalmazó hem. Azok sokszínűsége miatt:
- különbség a szerkezet a oldalláncok téma;
- különbség a szerkezet a polipeptid láncok;
- különbség a kommunikáció módja hem polipeptid láncok.
Attól függően, hogy a képesség, hogy elnyeli bizonyos hullámhosszú fény minden citokrómoknak csoportokra osztjuk a, b, c. Minden csoporton belül, az egyes fajok egyedi spektrális tulajdonságai jelentik indexszámok (B, B1, B2, stb).
Szerkezeti jellemzői a különböző típusú citokróm meghatározásához különbséget redoxpotenciálok. A CPE 5 típusú citokrómok részt (a, a3, b, c, c1). Kivéve citokróm c, citokróm minden található belső membránján mitokondrium formájában komplex protein komplexek.
QN2 dehidrogenáz (koenzim Q-citokróm c D uktaza komplex III) áll 2 típusú citokrómok (B1 és B2) és a citokróm c1. QN2 dehidrogenáz transzferek elektronokat ubiquinol citokróm c. Belül a komplex III elektronok átkerülnek a citokróm b on FeS-központok, citokróm c1, majd a citokróm c. Csoport témaköre mint Fès-központok, végezze csak egy elektron. Így, a molekula QH2 2 elektront átvisszük 2 molekula citokróm b. Mint közbenső terméket ezekben a reakciókban elektrontranszport képezhetnek szabadgyök se-mihinona. A citokróm b-típusú hem nem kötődik kovalensen a fehérjéhez, és a citokrómok c1 és ez kapcsolódik a fehérjéhez útján tioészter kötéseket. Ezek a kötések úgy keletkeznek, hogy két ciszteinmaradék a vinilcsoportok hem.
A citokróm C - vízben oldódó perifériás membrán fehérje, amelynek molekulatömege 12 500 D, amely egyetlen polipeptid-lánc, 100 aminosav, és a hem molekula kovalens kötéssel kapcsolódik a polipeptid.
A citokróm-oxidáz (komplex IV) áll 2 típusú citokrómok Aa3, amelyek mindegyike egy kötőhelyet oxigénnel. Citokróm-a és a3 jellegzetes zhelezoporfirinovuyu prosztetikus csoportot hem nevezett A és eltérő a hem citokrómok C és C1. Ez tartalmaz egy formilcsoport helyett egy metil-csoport és egy szénhidrogén lánc helyett egyik vinilcsoport. Egy másik jellemzője a komplex egy-a3 - a jelenléte azt a rézionok a fehérjéhez kötődött az ún astyu CuA-központok. Elektronok átvitelét és A3-komplex tartalmazza a reakció:
Cu + ↔ Cu2 + + e, Fe2 + ↔ Fe3 + + e.
A komplex citokróm a-a3 közvetlenül reagálnak molekuláris oxigénnel.
