A Egy atom tömege
Mass atom. atomsúly
Anyaga szakasz segít kideríteni:
> Mi a különbség a tömege atom és a relatív atomtömeg;
> Miért célszerű használni relatív atomtömeg;
> Hol található a relatív atomtömeg az elem.
Az elektron tömege mintegy 9 • 10 -28 g
A fontos jellemzője a atomsúlya. Majdnem az egész tömeg a atom koncentrálódik a sejtmagban. Az elektronok olyan kevés tömeget, hogy általában elhanyagolt.
Mérlegek atomok lehetetlen, mert rendkívül kicsi. Az tömegek számítással meghatározott.
A atomtömege Uránusz - a legnehezebb az összes atomok, amelyek megtalálhatók a Földön körülbelül
0,000 000 000 000 000 000 000 4 g
A pontos érték a tömeg egy atom urán - 3,952 • 10 -22 g, és a hidrogén-atom, a legkönnyebb az összes atom, - 1,673 • 10 -24 g
Használatuk nagyon kis számban kényelmetlen. Ezért ahelyett, hogy az „abszolút” atomtömege használnak, azok relatív súlyát.
A relatív atomtömeg.
A bármely atom tömegét lehet megítélni összehasonlítva azt a súlya más atomok. Korábban összehasonlítások vette a legkönnyebb atom - hidrogénatom. Most a tömege az atomok
1 Részletek a rekordok ezen számok, akkor vonják le a tanulságokat algebra a középiskolában.
Előtt 1961 atomtömeg-képest 1/16 tömegének oxigénatom.
képest 1/12 - Carbo tömeg atom (ez közel 12-szer nehezebb Hidrogén atom). Ez a kis tömege az úgynevezett atomi tömegegység (rövidítve - ae m ...):
1 a. e. m. = 1 / 12mA (C) = 1/12 • 1994 • 10 -23 g = 1,662 • 10 -24 g
Súly hidrogénatomot szinte egyenlő a atomi tömegegység: MA (H)
1a. e. m. A tömegű urán atomot tartalmaz a nagyobb
A szám, amely úgy kapjuk meg, a tömeg elem atommal atomi tömegegység, az úgynevezett relatív atomtömeg elem. Ezt az értéket a kijelölt A r (E):
Index közel a betű - az első betű a latin szó relativus - relatív.
Relatív atomtömeg elem jelzi, hogy hányszor súlya atomja nagyobb, mint 1/12 a tömeg Carbo atom.
A relatív atomtömeg elemnek nincs dimenziója.
Az első táblázat a relatív atomtömeg közel 200 évvel ezelőtt a brit tudós John. Dalton.
következtetéseket vonhatunk le a fentiek alapján anyaga:
• A relatív atomtömeg arányos a tömegek a atomok;
• tömegarányát atomok ugyanaz, mint a relatív atomtömeg.
Az értékek a relatív atomtömege a kémiai elemek rögzítik a periódusos rendszerben.
Dzhon Dalton (1766- 1844)

Kiváló angol fizikus és kémikus. Tagja a Royal Society of London (British Academy of Sciences). Az első feltételezték különböző méretű és tömegek a atomok, relatív atomtömeg azonosított sok elemet, és alkotja az első táblázatot az értékek (1803). Javasolt szimbólumok és szimbólumok a kémiai vegyületek.
Miután több mint 200.000 meteorológiai megfigyelések vizsgálatával szerkezetét és tulajdonságait a levegő, a részleges nyitott törvények (részleges) nyomás gázok (1801), a hőtágulási gáz (1802), az oldhatóság a gázok és folyadékok (1803).
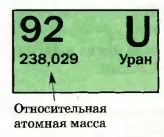
Ábra. 35. A sejt elem az urán
Ezek meghatározása igen nagy pontosságú; megfelelő számok alapvetően öt- és hat-ábrát (. 35).
A hagyományos kémiai számításokat értékek relatív atomtömege hozott kerekítést egészek. Tehát, a hidrogén és az Uránusz
Csak a relatív atomtömeg klórt van kerekítve egy tizedes:
► megkeresése a periódusos értékeinek relatív atomtömeg lítium, szén, oxigén, neon, és kerekítési őket egész számok.
► hányszor tömege Carbo atomok oxigénnel, neon és magnézium nagyobb, mint a tömeg egy hélium atom? A számításokat a lekerekített értékeit a relatív atomi tömegeket.
Megjegyzés. periodicheskoy elemek kerülnek a rendszer növekvő sorrendjében a atomtömegű.
Az atomok rendkívül kicsi tömeget.
Kényelmi számítás segítségével a relatív atomtömeg.
A relatív atomtömeg elem az arány a tömeges elem atommal - tömeges Carbo atom.
Az értékek relatív atomtömege vannak megadva a periódusos kémiai elemek.
?
48. Mi a különbség a következő fogalmak: „atomtömeg”, és a relatív atomtömeg „?
49. Mi az atomtömeg egység?
50. Mi a jelentése Ar és Ar felvételt?
51. Melyik atom könnyebb - vagy Titanium Carbo? Hányszor?
52. Mi egy nagy tömeg: fluorén atom vagy két lítium atom; Magnézium két atom vagy három kén-?
53. Keresse meg a periódusos rendszer három vagy négy pár elem visel korom-tömeget tartalmaz, és amely: a) 1. 2; b) 1. 3.
54. Számítsuk ki a relatív atomtömeg hélium, ha a tömeg egy atom, amely elem 6,647-10 -24 g
55. Számítsuk ki a tömeg a berillium atom.
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.