A gerjesztett állapota egy atom

Home | Rólunk | visszacsatolás
A gerjesztett állapot az atom - energetikailag instabil állapot, amelyben az atom megy, hogy az energia kívülről. A gerjesztett állapotból az atom csak egy rövid időre is laknak. Izgatott atom, amely az energia visszatér az alapállapotba.
Kölcsönhatás, különben a donor-akceptor-donor akceptor kötés; koordinációs kötés - reagáltatunk, alapuló töltésátviteli vagy elektron transzferre a donortól az akceptorként.
Donor-aktseptoronoe interakció magában foglalja azon eseteket töltésátviteli közötti donor és akceptor molekulák képződése nélkül kémiai kötések között, és át a nem megosztott elektronpár a donor, hogy az akceptor, így a kialakulását egy kötés.
Az első esetben lehet, például egy szerves donor, különösen - Donor, például tetrakisz (dimetil-amino) -etilén- (TDAE), más telítetlen amin-vegyületek, metallocének, stb, és a szerves akceptorok, így például fullerének vagy quinodimethane akceptor .. szubsztituensek. A reakcióban ilyen vegyületek komplexbe töltésátviteli, ahol a negatív töltésű akceptor és a donor Interact pozitív töltésű elektrosztatikusan. Fontos szerepet játszott egy ilyen rendszer, ahol az elektronikus alapállapot díj átadása csak részleges, akkor az állam szinte teljes díj átadása elő lehet állítani photoexcitation. Az ilyen rendszerek, donor-akceptor diads és triád, amelyben a donor és az akceptor bevezetett áthidaló csoport hozzájárul az állam az élettartama a töltésátviteli lehet használni létrehozására eszközök átalakítására napenergia (lásd. Pl, mesterséges fotoszintézis). Általában a töltés közlekedés különböző formái és megnyilvánulásai, kulcsszerepet játszik számos biológiai folyamatokat.
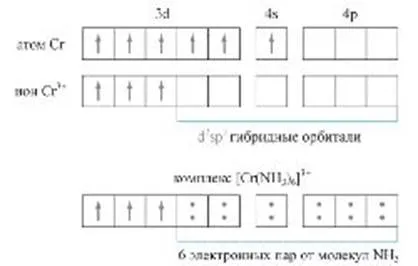
A második esetben, a donor és az akceptor rendre egy sav és egy Lewis-bázis. Ha a normál kovalens két atom közötti kötést közös képződése miatt elektron pár - egy-egy atom, a donor-akceptor kötés végzi egy pár elektron donor és a szabad (töltetlen) akceptor pályák. Ez a fajta donor-akceptor kölcsönhatás - az alapvető folyamat kialakulásának komplex vegyületek (ábra.). Az ilyen kölcsönhatás felelős számos sav-bázis átalakítás, transzferéhez kapcsolódó hidrogén-ion (akceptor), valamint a kialakulását szupramolekuláris nanostruktúrák.
Irányhatás kovalens kötés az eredménye aspiráció atomokkal egy erős kötést valószínűleg a magasabb elektronsűrűség között a magok. Ezt úgy érjük el, a térbeli tájékozódás az átfedés az elektron felhők, amely egybeesik a saját. A kivétel a s-elektron felhők, mert a gömb alakú teszi minden irányban egyenlő. A p- és d-elektron felhők átfedés végezzük tengely mentén, amelyen kiterjesztik, és kialakítva ennek kapcsán az úgynevezett # 963; -bond. # 963; -Kommunikációs axiális szimmetria és két atom lehet forgatni mentén összeköttetéshez, vagyis, hogy egy képzeletbeli vonalat, amely keresztülmegy a mag a kémiailag kötött atomok.
Képződése után két atom között # 963; -bond a többi az elektron felhők az azonos alakú és azonos főkvantumszám * marad csak a lehetőségét oldalirányú átfedés mindkét oldalán a link. Az eredmény egy π-kötés. Ez kevésbé erős, mint # 963; -Kommunikációs: átfedések diffúz pályák az oldalsó részek. Minden többszörös kötés (például kettős vagy hármas) mindig csak egyetlen # 963; -bond. szám # 963; -kötéseken képező központi atom a komplex molekulák vagy ionok, értéke határozza meg a koordinációs száma. Például, egy NH3 molekula és NH4 + ion a nitrogénatommal azonos három és négy. képződés # 963; -kötéseken rögzíti a térbeli helyzetét az atomok egymáshoz képest, így a több # 963; -kötéseken, és a szögek között a csatlakozó vezetékek, amelyek úgynevezett vegyérték szögek határozzák meg a térbeli geometriai konfiguráció molekulák.
Értékelésekor a átfedése elektron felhők kell tekinteni jelei a hullám funkciók elektronok *. Amikor az átfedés felhők azonos jelek a hullám funkciók a elektronsűrűség közötti térben a magok növekszik. Ebben az esetben van egy pozitív átfedés, ami kölcsönös vonzás magot. Ha a jelek a hullám funkciók ellentétes, az elektron felhő sűrűsége csökken (negatív átfedés), ami a kölcsönös taszítása a magok.
Ionos kötéssel - kovalens speciális esetben, amikor a képződött elektronpár teljes egészében az a elektronegatívabb atommal válik az anion. A szelekció alapjaként ebben a tekintetben, egy adott típusú, az a tény, hogy a vegyületek, amelyek egy ilyen kötés lehet leírt elektrosztatikus közelítése, feltételezve ionos kötést okozta vonzás a pozitív és negatív ionok. A kölcsönhatása ionok ellenkező előjelű nem függ az irányt, és a Coulomb-erő nem rendelkezik a tulajdonsága telítettség. Ezért egyes ionok az ionos vegyület vonz ionok száma ellenkező előjelű, alkotnak kristályrácsban ionos típusú. Egy ionos kristály molekulák ott. Minden ion körül egy bizonyos számú ionok ellenkező előjelű (a koordinációs száma az ion). Ionpárok létezhetnek gázállapotban formájában poláris molekulák. A gáz-halmazállapotú NaCl egy dipólus momentummal
3 # 8729; 10 -29 Cl # 8729; m, amely megfelel elmozdulásnak 0,8 elektron töltése a kötés hossza 0,236 nm Na Cl, azaz Na Cl 0,8- 0,8 + ...
Amellett, hogy a különböző heteropoláris és go-meopolyarnyh kapcsolatok, van egy másik speciális típusú kommunikáció, amely az elmúlt két évtizedben azonban egyre növekvő figyelmet a vegyészek. Ez az úgynevezett hidrogénkötés. Azt találtuk, hogy a hidrogénatom kötést képezhet két elektronegatív atom (F, O, N, Cl és kevésbé S). Vannak esetek, amikor ez a kötés képezi hidrogénatom kötődik egy szénatomon NSKH3 típusú vegyületek, amelyekben X - elektronegatív atom vagy csoport (például, HCN, fluorozott szénhidrogének). Bár jelenleg a természet a hidrogénkötés még mindig nem teljesen ismert, odna.ko definiált-dimenziós ábrázolása ez már lehetséges, hogy a.
A hidrogénkötés között van kialakítva elektronegatív atomot tartalmaz, amelyek közül legalább egy szabad elektronpár, például:
Hidrogénmegkötő (jelöljük fantom három pont).
Így a hidrogénkötés természeténél fogva, úgy tűnik, az elektrosztatikus; Ez alkotja a vonzás kovalensen kötött proton szabad elektronokat másik molekula atomok. Ebben az esetben, a proton nem a közepén az atomok közötti kötési őket (akkor is, ha azok azonosak), és közelebb az atom, amelyhez kovalens kötéssel. Például, abban az esetben a víz
egy egyenlő távolság O-H 0,99 A és 1,76 A. További
Az a kérdés, hogy a hidrogén egy fix helyzetben, vagy oszcillál két egyensúlyi helyzete, az általános esetben még mindig nem tisztázott, bár a tanulmány által kinhidron nyomjelző jelzi a rögzített helyzetben a hidrogén kötés van ez a vegyület a hidrogénatom.
hidrogénkötés energia kicsi; ez a sorrendben 5-10 Kcal / mol, míg például, normális kommunikáció energia O-H 109 kcal / mol, és a kommunikációs H-F 148 kcal / mol. A olvadó jég megtöri körülbelül 15% a hidrogénkötések víz hevítésével, hogy 40 ° C-on körülbelül fele szünetek hidrogénkötések. A vízgőz a hidrogénkötések szinte nincs. Olvadáskor a hidrogén-kötések megszakadnak alkoholok kicsit, de ezek teljesen elszakadt során párolgás. Az autó-síkos savak, hidrogén kötések nem törött, és a párolgás, úgy, hogy, például, a hangyasav gőzfázisban dimerként létezik
Azonban, ebben az esetben, egy hidrogénkötés-energia csak körülbelül 7 kcal / mol.
A hidrogén jelenléte kötés jelentős hatással van a fizikai tulajdonságait a vegyületek. Azaz, a hidrogénkötések felelős az egyesület a víz és alkoholok, és ennélfogva azok abnormálisan magas forráspontú viszonylag, például hidrogén-szulfid és merkaptánok. Az a képesség, alkoholok, aminok, karbonsavak, amidok oldódik a vízben képződése miatt a hidrogén kötések vízzel molekulákkal. Bizonyos vegyületek, mint például az enol forma atsetouksus-Nogo-észter, o-nitro-fenolt, és mások. Intramolekuláris hidrogénkötések a bezárási ciklusban. Tanulmány a hidrogénkötések kell további felvilágosítást nyújtottak a szerkezetét és tulajdonságait a sok szerves anyagot.
Fluorid berilliumot F (2) - üveges anyag. A szerkezet tartalmaz egy rendezetlen hálózata berillium atomok (CN 4), hidak kötik össze a fluoratommal, és hasonló a kvarcüveg. Fent 270 ° C-berillium-fluorid spontán kikristályosodik. Mint a kvarc, létezik az alacsony hőmérsékletű a-forma, amely 227 ° C-on lép be a b-alakú. Akkor is kap a forma krisztobalittá és tridimit. Közötti strukturális hasonlóságok SiO2 és BeF2 is kiterjed fluoberyllates (amelyeket reakciója során keletkező berillium-fluorid-fluoridok alkáli elemek és ammónium) és szilikátok. Berillium-fluorid - fluoberyllate üveg összetevő és só keveréket használják nukleáris reaktorok, sóolvadékos.
Egy vízmolekula áll két hidrogénatom (1H) és egy atom oxigén (16O). Kiderült, hogy szinte az összes sokféleségét víz tulajdonságai és az a szokatlan megnyilvánulásai meghatározzuk, végső soron, a fizikai természetét ezek az atomok, hogy a módszer az egyesülési és csoportosítás a molekulában kialakított külön vesszük figyelembe molekul.V vízmolekula hidrogén és oxigén atomok, vagy inkább a magok vannak elhelyezve úgy, hogy egy egyenlő szárú háromszög. A tetején, hogy - egy viszonylag nagy az oxigén lényege a sarkok mellett a bázis, - az egyik mag vodoroda.V szerinti elektronikus atomok hidrogén és oxigén vízmolekula öt elektron pár. Ezek képezik egy elektron felhő. A felhő inhomogén - meg lehet különböztetni egymástól az egyes páralecsapódás és ritkítás. A lényege az oxigén létrehoz egy feleslegben elektronsűrűség. Belső elektronpár oxigén egyenletesen körülveszi a mag: ez vázlatosan egy kör középpontja - a mag O2-. Négy külső elektronok vannak osztva két elektron pár, vonzódik a mag, de nem részben kompenzált. Vázlatosan, a teljes elektron pályák Ezen párok mutatjuk kiterjedő ellipszis formájában egy közös középpont - O2- sejtmagba. Mind a fennmaradó két oxigénatomot képez egy elektronpár az egyik elektron hidrogénatom. Ezek a párok is vonzza az oxigén sejtmagba. Ezért a hidrogén atommag - protonok - némileg csupasz, és itt hiány van az elektronikus plotnosti.Takim, a négy pólusai a díjak különbözteti meg egy molekula víz: két negatív (feleslegben elektronsűrűség a oxigén mag) és két pozitív (hiánya elektronsűrűség a két hidrogén atommag ). A jobb áttekinthetőség érdekében, el tudjuk képzelni, hogy a pólusok csúcsait foglalják el a deformált tetraéder, amelynek központja egy oxigén nucleus