A mechanizmus a kötés kialakulása
Nemfémes atom vesz külső elektronokat a fématom és átalakul anionok (negatív töltésű ion). A fématom veszít elektronokat, és átalakul egy kation (pozitív ion). Ionokat köti elektrosztatikus erők. Van egy teljes hozam (elfogadása) a vegyérték elektronok, nincs átfedés a felhő megosztását elektronok figyelhető meg.
1. Az ionos vegyületek olvadáspontja magas és alacsony illékonyság. Ez a jelenség annak köszönhető, hogy az erős elektrosztatikus vonzás közötti kationok és anionok a vegyületet. Így a kristály cézium-klorid, cézium-ion körül nyolc klór ionok jelen a legrövidebb távolság, és az egyes klorid iont - nyolc céziumionokat.
2. ionos vegyületek általában egy alacsony elektromos vezetőképességű anyagot a kristályos állapotban, mivel az ionok a kristályrácsban, nem képesek a transzlációs mozgást. A olvadékok ionok, például képes erősítés, ami az ionos megolvasztja vegyületek jó oka az elektromos áram.
3. Az ionos kristályok kemény, de törékeny. A keménysége ionos vegyületek hiánya miatt az irány, amelyekben a kristályrács lehetett deiamináini, mint például abban az esetben, grafit kristály. Morzsálódás ionos kristályok annak a ténynek köszönhető, hogy még egy enyhe deformáció a rács kíséri konvergenciája ugyanolyan töltésű ionok, ahol az egyensúlyt a taszító és vonzó erők elromlott, és a kristály eltörik.
4. Az ionos vegyületek rendszerint jól oldódnak poláros oldószerekben. Poláris oldószerek jellemző a magas értékek dielektromos állandó, amely kapcsolatban van a kölcsönhatási energia két töltött részecskék egyenlet.
12. Fémes kötés: kialakulásának mechanizmusa, jellemzői a kommunikáció.
Me-tal-e-che-lic kommunikáció - egyfajta kommunikáció me-tal-kristályok és SPLA szigetek atomok közötti-ma-mi vagy ion-MI me-tal-fogás és járulékos no-see-Tel még a baud-HN-E elektro-nitro-na-mi (elektro-tron NYM gáz) volt Cree-Th-Are-D-XYZ Sheth-ke.
Mechanizmusa-RA-zo-va-Niyama-tal-li-Th-CIÓ svyaziso-száz-következik egy do-edik jelen atomokban me-tal-halászat da oldjuk Rouge elektron-WIDE TPO minket, neko-the-rozs előre Vera-vezető-by-Xia az on-lo Ms Tel de a zárda-feleségek-WIDE ionok. Oto-rvav-shi-i-Xia-atom távolságra mov elekt-tro-HN-A-de-B de Tel-baud NE-no-re-me-vezetőképes-oldott Xia a kocsi között a-nick-Shih mi-lo Ms-Tel-HN-mi-mi ion me-tal-halászat. Ezek között a ca-sti-ca km cart-nor-ka-me-tal-li-Th-lic kötés, r. F. Elec-nitro-HN mint TSE-men-ti-pi-feloldjuk lo -zhi-Tel-WIDE ionok a me-tal-e-che-CIÓ újra Sheth-kyo.
Jellemzők. Minden fém jellemzi elektromos és hővezető, alakíthatóság, fémes fényű, általában szürke színű és áttetszőségét.
13. A kovalens kötés: kialakulásának mechanizmusa, jellemzői a kommunikáció.
Kovalens kötés - a kémiai két atom közötti kötést, szocializáció akkor történik, amikor az elektronok tartozó ilyen szénatomok.
Abban az esetben, egy nem-poláros kovalens kötés elektron felhő által alkotott közös elektronpárt, vagy elektronikus kommunikációs felhő szimmetrikusan elosztva térben képest a magok a két atom. A példák közé tartoznak kétatomos molekulák álló atomok egyik eleme: H2. Cl 2. O2. N2. F2 és mtsai., Amelyben az elektron pár egyaránt tartozik mindkét atom.
Abban az esetben, a poláris kovalens kötés elektronikus kommunikációs felhő eltolódott az atom nagyobb elektronegativitási relatív. Ennek egyik példája a molekula illékony szervetlen vegyületek: HCI, H2 O, H2S, NH3 és mások.
kovalens kötés kialakulásának mechanizmusát.
· Az Exchange - vesz részt összekapcsoljuk a egyetlen elektron atomi pályák, azaz minden egyes atom rendelkezik általános használatra egyetlen elektron.
· Donor-akceptor - kötés kialakulása végbemegy, mivel a elektronpár donoratom és üres pályák a akceptor atom.
· Telíthetőségével - meghatározza sztöchiometriája (mennyiségi összetétele), molekuláris kémiai vegyületek.
Ez a funkció abban a tényben rejlik, hogy minden egyes atom csatolja csak egy bizonyos számú más atomok. Tehát általánosságban, egyszerű gáz-halmazállapotú anyagok állnak atomok 2: O2. Cl 2. N2, stb
· Orientation - meghatározzuk a térszerkezet a molekula (molekula formában). Irányhatás függ: 1) - a atomok száma a molekulában; 2) - a típusú kölcsönhatás az elektron felhők.
Molekulák a következők lehetnek:
· Háromszög - BCI3. AICI3 (sík);
Egyszerű anyagok kétatomos molekulák (H2. O2. Cl2 stb) elektron párokat, amelyek kovalens kötéseket tartoznak egyaránt vonatkoznak tartalmaz, és ezért a középső közötti központok, azaz a teljes elektron felhő szimmetrikusan. Kommunikáció ebben az esetben az úgynevezett nem-poláros (kovalens).
14. A hibridizáció atomi pályák.
Pályák Hibridizálás - keverésének folyamata különböző hipotetikus (s, p, d, f) pálya a központi atom egy többatomos molekula nem fordul elő azonos pályák, amelyek egyenértékűek a saját jellemzői.
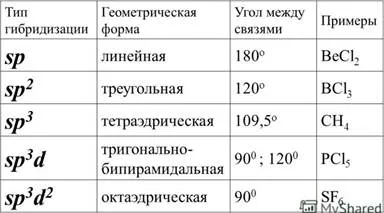
15. A szerkezet a komplex vegyületek. A disszociációs a komplex vegyületek. A disszociációs állandó a komplex vegyületek.
Komplex vegyület, - megformált részecskéket pozitívan töltött fémionok lehet körülvéve anionos vagy semleges molekula.