A robbanások a gáz-levegő keverék
Ha képes meggyújtani az éghető gázkeverék van egy zárt térben, mint például zárt, a berendezés vagy a vezeték elegendően nagy átmérőjű, a előfordulása bármely ponton a nyílt láng térfogata, egy elektromos szikra vagy fűtött test, amelynek hőmérséklete elegendő a gáz gyújtás, robbanás történik . A robbanás egy olyan jelenség, rendkívül gyors gyújtás és az égés összes azonnal rendelkezésre álló térfogat gázkeverék. Felrobbant nem csak gáz-halmazállapotú tüzelőanyaggal. Bizonyos körülmények között, robbanás következhet be keverékei gőz-folyadék éghető levegővel és a por a levegőben szuszpendált szilárd éghető.
Rapid elégetve a tüzelőanyagot a robbanás kíséretében igen gyors növekedése a hőmérséklet, és ennek következtében
hirtelen emelkedése nyomását felmelegített gáz. Ez gyakorlatilag azonnali és hirtelen nyomásnövekedés zárt térben, amely foglalkozik az üzemanyag keverék a robbanás előtt, vezethet pusztító következményekkel. Nyomás által generált a robbanás a gáz-levegő keverékek lehet akár 0,7-0,8 MPa, ha a keverék, hogy a robbanás a normál légköri nyomáson. Ha a gázkeverék a robbanás előtt már emelt nyomáson, a nyomás a robbanás annyira magas, mint a nyomás a keverék volt - a normális fölött. A robbanások nyomású gáz-oxigén keverékekkel lényegesen magasabb, mint a robbanások a gáz-levegő keverék.
A mértékű a nyomás fejlődő a robbanás a gázkeverék, lehet meghatározni a következő képlet segítségével:
Rvzr ahol - az abszolút nyomást a robbanás során, MPa;
Rnach - kezdeti abszolút nyomáson a keverék, MPa;
tvzr - hőmérsékletek fejlődő a robbanás során, amelyek a határ a maximális érték;
Tstart - a kezdeti hőmérséklete gázkeverék; ° C;
m - száma mennyiség (m 3) gáz égéstermékek a figyelembe véve a légköri nitrogén;
N - száma mennyiség (m 3) a levegő-gáz keverék, hogy a robbanás, továbbá figyelembe véve a légköri nitrogén.
Mivel, a maximális égési hőmérséklet szinte nem érik, de keveréke gáz és levegő csak véletlenül lehet olyan, hogy nem lesz felesleges ott, sem nem a levegő képest az elméleti összeget, a tényleges nyomás robbanások a gáz kevesebb lesz, mint a maximálisan lehetséges, t . e 0,7 -. 0,8 MPa. Különösen veszélyes robbanás elleni gázok alacsonyabb ARH, mivel ebben az esetben a gázkeverék képződik inkább képes begyulladnak azonos feltételek mellett. A közvetlen értékeket lel két gáz veszélyes egyik, amely szélesebb területen robbanásveszélyes és alatt a gyújtási hőmérséklet.
A szénhidrogén-gázokat Cm · Hn kémiai egyenlet égési reakció oxigén formájában
m-, ahol a szénatomok száma a szénhidrogéngáz;
N - hidrogénatomjai számának a gázt;
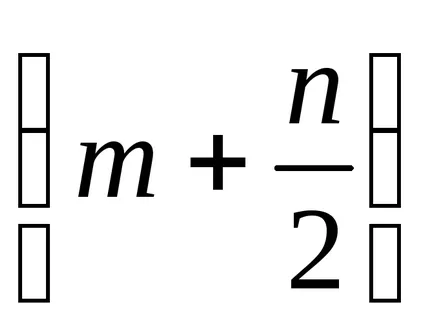
Szerint (8) képletű, az egyenlet égő éghető gázok lenne:
Gyakorlati szempontból az égési gáz oxigén nem hozott a tiszta formában, hanem egy alkatrész a levegő.
Mivel a levegő áll térfogat 79% nitrogént és 21% oxigént oxigén mennyiség igényel 100. 21 = 4,76 térfogat levegő vagy 79. 21 = 3,76 nitrogén térfogata.
Így tehát az égési reakció metán a levegőben leírható egy egyenlet formájában
Ebből az egyenletből nyilvánvaló, hogy a belső égésű 1 m3 metán szükséges 2 m 3 oxigén és nitrogén, vagy 2 7,52 + 7,52 = 9,52 m 3 levegő (lásd. 6. táblázat).
A toxikus tulajdonságai és fojtó gázok
Földgáz (a metán, etán, propán, bután, stb), kivéve azokat, amelyek jelentős mennyiségű hidrogén-szulfid általában nem toxikusak. Azonban, magas koncentrációban a földgáz a levegőben van egy oxigénhiány, amíg fojtó. Azáltal csökkentjük az oxigéntartalmat a belélegzett levegő követően megfigyelt fiziológiai állapotok: a 17% - légszomj és palpitáció, 12% - erősen korlátozott légzés, 9% - ájulás. Homológok metán - etán, a propán, a bután, szintén tartalmazza a földgáz közvetlenül az emberi enyhén narkotikum.
6. táblázat - több oxigén és a levegő az égés során gázok
Univerzális gáz állapotegyenlet megvizsgáltuk a 3. fejezetben Ezen kívül egy pillantást a állapotegyenlet a gáz a Virial együtthatók
Ebben az egyenletben a redukált Z szuperkompresszibilitási tényező hatványsorba. B, C, D - rendre két-és négyágyas tripla Virial együtthatók függvényében csak a hőmérséklet, és nagymértékben függ a molekuláris kölcsönhatások, amelyek egyidejűleg részt, illetve két, három és négy molekula a gáz. Határozzuk meg a szuperkompresszibilitási Virial együtthatók és együtthatók lehetnek pontosabban csak a gázok, amelyek egyszerű molekulák, például oxigén, nitrogén.
A kinetikus-molekuláris elmélet egy tényezőt figyelembe kell venni erejét molekuláris kölcsönhatás Z. És ha Z <1 то преобладают силы притяжения если же Z> 1 uralja a taszító erő Z = 1 állapotban molekuláris erők egyensúlyi.
Az 1. ábra a variációs viselkedést szuperkompresszibilitási faktor függően nyomás állandó hőmérsékleten gáz.
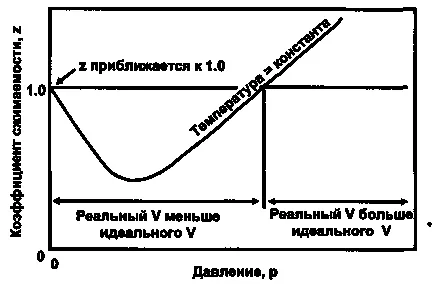
1. ábra Egy tipikus grafikon szuperkompresszibilitási változási aránya nyomás állandó hőmérsékleten
A legszélesebb körben meghatározó szuperkompresszibilitási tényező a gázkeverékek földgáz mezők ig terjedő nyomáson, 70 MPa-eljárással kapott meghatározásának a grafikon a 2. ábrán látható Ebben grafikonon alapján készítettük elvének megfelelő állapotok, azaz az azonos értékeket adott nyomáson és hőmérsékleten RPR Tcal különböző anyagok hasonló értékeket szuperkompresszibilitási faktor Z.
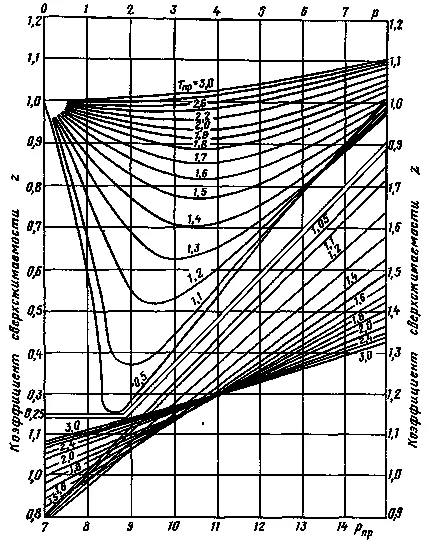
2. ábra: A függőség szuperkompresszibilitási faktor Z a földgázt a fenti nyomást és hőmérsékletet.
Meghatározására szolgáló eljárások szuperkompresszibilitási tényezője Z jelentése a következő. Kezdetben, 2. és 3. ábra, illetve a (2) képlet függően a relatív sűrűség és a gáz összetétele határozza srednekriticheskie nyomás és hőmérséklet, valamint az adott nyomáson és hőmérsékleten.
Srednekriticheskie (pszeudokritikus) a nyomás és a hőmérséklet a keverék lehet kiszámítani a következő képlet szerint (2):
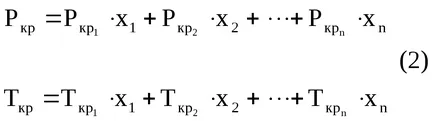
ahol x1. x2 ..., xn - térfogatarányából a komponenseket a készítmény a gáz;
Rkr1. Rkr2 ... Rkrn - kritikus nyomás alkatrészek;
TP1. TR2 ... Trn - a kritikus hőmérséklet a komponenseket.
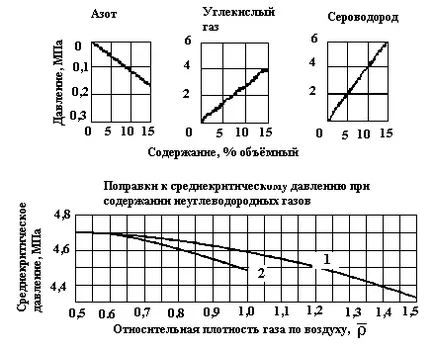
3. ábra függés srednekriticheskogo nyomást a relatív sűrűsége a gáz a levegőben: 1 - gázmezőkön; 2 - gáz kondenzátum mezők (
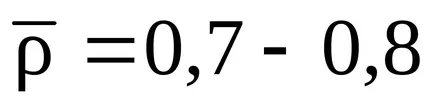
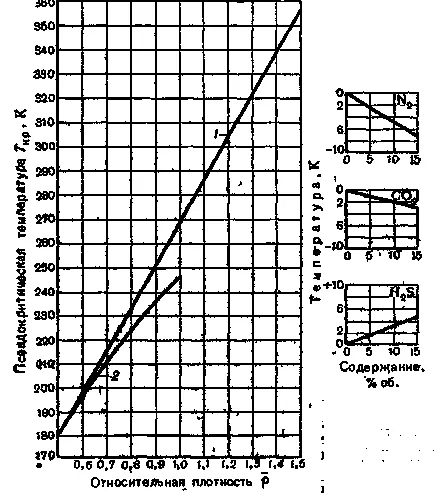
4. ábra függés srednekriticheskoy hőmérséklet a relatív sűrűsége a gáz a levegőben:
1 - gázmezőkön;
2 - kondenzátum mező ().
Ha a tartalom N2 gáz. CO2 és H2 S több mint 15% -a térfogat egyenlet helyett használható a grafikonok, hogy meghatározzuk és a TCR PCR (2).
Ezután, a függőség az 1. ábrán látható meghatározzuk, és a megfelelő RRP és Tpr szuperkompresszibilitási faktor értéke Z.
Az 1. táblázat adatai néhány fizikai-kémiai paraméterek a komponensek szerepelnek a földgáz.
Mint korábban említettük, a tartály körülmények között a kondenzátum mezők magas forráspontú szénhidrogének (C5 + H12), amelyek jelen vannak a készítményben a benzin, kerozin és az olaj frakciók forráspontú hőmérsékleten legfeljebb 500 ° C A tömeghányada etán és a propán - bután frakció eléri a 25%
1. táblázat alapvető tulajdonságai a természetes gáz komponenseket
A készítményben a magas forráspontú szénhidrogén kondenzátum tartályt rendszer foglalt három kémiai csoportba szénhidrogének: metán, nafténes és aromás, és ezek a kapcsolatok nagyon eltérőek a különböző gáz kondenzátum betétek. A 2. táblázat rövid leírását számos CIS gázsűrítmény betétek.
minél magasabb a formáció nyomás és hőmérséklet. Meg kell jegyezni, hogy a feltételek a lerakódásokat jelentősen befolyásolhatja a minta.
Ebben a tekintetben a természetben találkozhatnak háromféle gázsűrítmények - telített és túlhevített undersaturated. Az utóbbi típusú betétek jellemző, hogy a tározó hőmérséklete meghaladja a kritikus kondenzációs hőmérséklet tároló-rendszer.
Telített kondenzátum rendszer alakult, ha során a lerakódásokat vannak tápforrásainak magas forráspontú szénhidrogének a gázfázisú (olaj peremén vagy közelében olajmezők hazudik).
2. táblázat kvalitatív jellemzői kondenzációs
A lapított tartály rendszerek még magas tartalma C5 + szénhidrogéneket magassága tartálynyomásra gázok mindig alatta van a harmat képződését.
Meg kell jegyezni, hogy a jellemző a gáz kondenzátum koncentrációjának csökkentésére az etán propán és propán bután, míg a kőolaj- gázok, az említett szabályosság hiányzik.
A gáz kondenzátum betétek, ez az érték 2 - 6. Az arány a metán mennyiségének C1 / C2 + nehéz szénhidrogéneket egy gáz-kondenzátum betétek körülbelül 10, míg oldott gázok az olaj 13.
- alacsony kéntartalmú és maloaromatizirovannye;