Befolyásoló tényezők a hidrolízis sót
A gyengébb sav (és / vagy bázis), annál inkább a hidrolízis vetjük alá annak sóját. sót hidrolízissel állandó csökkenésével növekszik sav disszociációs állandó (és / vagy bázis):
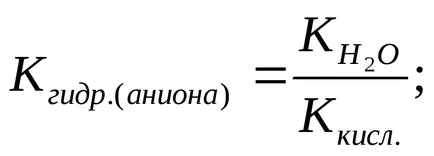
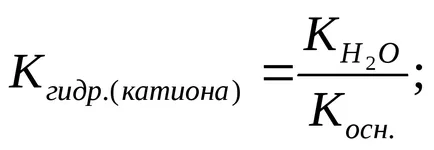
A hidrolízis foka (h) kiszámítható a következő képlettel
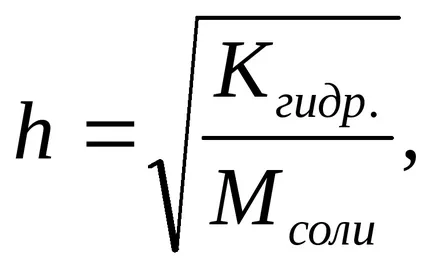
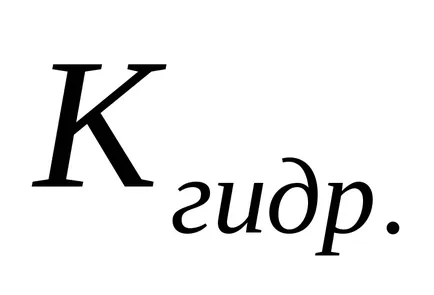
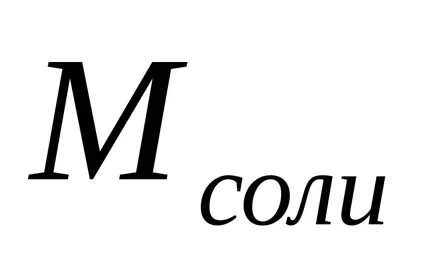
A csökkenő só koncentrációja az oldatban növeli a hidrolízis foka, azaz a „A hidrolízis fokozódik.”
Hidrolízis - reverzibilis endoterm folyamat folytatja a hő elnyelését (ΔNgidr> 0.). Összhangban a Le Chatelier elve melegítve hidrolízis egyensúly eltolódik egy endoterm reakció, azaz termék képződését, és ennek következtében a „hidrolízis amplifikált.” Lehűtés után - hidrolízis egyensúly felé tolódik el a kiindulási reagensek, azaz „Hidrolízis gyengül.”
Az idegen anyag jelenléte, amely „az azonos nevű” ionok.
Addíciós sói, a hidrolízis termékek az oldatban összhangban Le Chatelier elv vezet eltolja az egyensúlyt felé hidrolízisét a kiindulási reagenseket, azaz „A hidrolízis elnyomott.”
a) NH4 + + H2 O
Hidrolízise a kation elnyomják az erős savak jelenlétében, a koncentrációját növeljük H + ionok.
b) F - + H2 O
Hidrolízise az anion elnyomják az erős bázisok jelenlétében, amelyek növelik a koncentrációját OH - ionok.
6.Osnovnye előállítási eljárásai-oxidok és -hidroxidok
6.1. Előállítására szolgáló eljárások oxidok
Egyszerű anyagok oxigénnel reakcióba lépve (égési reakció).
2Ca + o2 → 2CaO
Termikus bomlás komplex anyagok.
- fém-hidroxidok vizet veszítenek melegítés:
2AL (OH) 3 → Al2O3 + 3H2O;
kivéve a alkálifém-hidroxidok, amelyek megolvadnak bomlás nélkül;
- rosszul oldható sav formában oxidok melegítés hatására megfelelő a számukra,
sav, szilícium (IV)
- könnyen elbomlott sók, savképző illékony oxidok:
karbonátok és hidrogén-karbonátok, szulfitok:
oxid, karbonát-oxid
Carbon Kalcium (IV)
- tartalmazó sók anionjai - oxidáló hevítve vannak kitéve intramolekuláris redox:
ammónium-króm (III)