Elektrokémiai konverterek - studopediya
Elektrolitikus (konduktometriás) átalakítók. A működési elve az elektrolitikus átalakítók alapuló elektromos vezetőképessége az elektrolit oldat, attól függően, hogy annak koncentrációja. Mint ismeretes, az elektromos vezetőképesség desztillált víz nagyon alacsony. Amikor abban oldott savak, sók, bázisok (elektrolit) vezetőképesség nő. Amikor vízben oldjuk, az elektrolitok disszociálnak pozitív és negatív ionok; ahol a vivők száma és az oldat vezetőképessége növekszik. Alacsony elektrolit koncentráció, ha
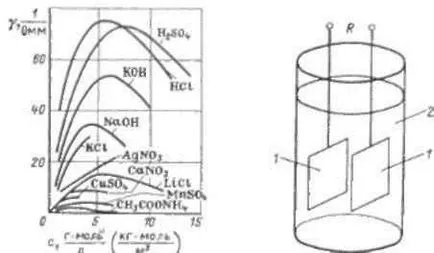
ionok mennyiségének kicsi, növeli az elektromos vezetőképesség arányosan az oldott anyag koncentrációját. Amikor a koncentrációja a kapott közötti kölcsönhatás ionok, és csökkentse a disszociációs mértéke arányosság van törve (ábra. 29).
Elektrolitikus átalakító (30. ábra) jelentése két elektróda 1, belemerül az elektrolit oldat 2. konvertereket használnak főleg koncentrációjának mérésére a megoldások, továbbá, ezek mérésére elmozdulás, sebesség, mechanikai behatás, hőmérséklet és egyéb fizikai mennyiségek. A átalakítók koncentrációjának mérésére, az elektródák készülnek stacionárius. Az R ellenállás az elektródok között a jelátalakító fordítottan arányos a fajlagos elektromos vezetőképesség az elektrolit:
Factor nevezzük állandó hajtás. Ez határozza meg kísérletileg impedancia konverter oldattal töltött egy ismert érték 7.
Galvanikus átalakítók. A működési elve az elektrokémiai átalakító alapján a függőség a elektród potenciál a koncentrációja az ionokra oldatban. A fém elektród elmerül az elektrolit oldatban részlegesen oldódik benne. Pozitív fémionok át az oldatba, és az elektróda kap negatív töltés. Alakult közötti potenciálkülönbség az elektróda és az oldatot megakadályozza az átmenetifém-ionok, és az elektród oldódás megáll. Egyensúlyban az elektromos potenciál az elektród koncentrációjától függ az ionokra oldatban és lehet használni, hogy meghatározzuk azok koncentrációjától.
Szerkezetileg, az elektrokémiai átalakító áll a két fél-cella, és amely villamosan össze van kötve
között egy elektromos kulcsot 3. A fél-cella egy hajó egy elektrolit oldattal, amely belemerül a fém elektród. Az egyik félcella egy olyan megoldás, amelynek koncentrációját pedig a másik - egy ismert koncentrációjú. Elektrolitikus gomb - egy cső oldattal töltött KC1 és zárt mindkét oldalán dugókon vatta vagy azbeszt. Converter E EMF mért a két elektród között határozza meg az ismeretlen koncentráció.
Nagy jelentősége van meghatározása a hidrogénionok koncentrációját H megoldásokat. Tiszta desztillált víz, bár enyhén, de disszociál ionokra. Szerint a tömeghatás törvénye és mert az alacsony víz disszociációs ionos termék vízben
ahol ah + nOH - - koncentrációja H + ionok és az OH, kifejezett mol / l.
Ionos termék víz - állandó, 22 ° C-on egyenlő 10
14. Ha a savat vízben oldjuk, a disszociációs molekulája a H + ion koncentrációja növekszik, és így csökkenti a koncentrációja OH - ionok. Oldódási bázisok megváltoztatja a koncentrációja H + és OH - az ellenkező módon. A hidrogénionok koncentrációját jellemző az oldat savasságának. Savassága befolyásolja során számos kémiai reakciók és biokémiai folyamatokat. A mértékegység annak pH-értéke
Mérési galvanikus elektromotoros erő átalakítók kell végezni és minimum, mint akkor, ha az áram folyik megváltozott, és az elektrolízis oldat koncentrációja az elektróda régióban, ami hiba. Ezen felül, az áram a feszültségesést egy meglehetősen nagy belső ellenállása inverter, amely bevezet egy hiba a mérési EMF. PH-EMF mérjük a földalatti vagy elektronikus voltmérő nagy bemeneti impedancia, vagy potenciométerrel kézi vagy automatikus kiegyensúlyozás.
EMF elektrokémiai átalakító a hőmérséklettől függ. Hibák csökkentése automatikus pH-mérőket thermo-helyesbítő áramkör.