És hőmérséklet mérés
Amikor a termikus egyensúly 2-test:
- nincs hőcsere és fázisátmenetek
- y 2 testek ugyanezen a hőmérsékleten, és kinetikus energiája molekulák
- Ez nem változtat a nyomás és térfogat.
Hőmérséklet - fizikai mennyiség leíró termodinamikai egyensúlyban, amely jellemzi az intenzitása a véletlenszerű mozgás molekulák.
Hőmérséklet mérés útján történik hőmérők.
Hőmérő - olyan eszköz, amelyben a gáz mennyisége vagy folyékony, a hőmérséklettől függ.
Hőmérők gáz és folyadék (higany és alkohol).
Hőmérők mindig érintkezésbe hozzuk a mérési test előtt a termikus egyensúly.
Hőmérséklet - leírása az egész testet, nem egy molekula.

Ticket №8. Egyenlet Mengyelejev-Clapeyron. Clapeyron. Izoprotsessy gázokban.
Ez az egyenlet írja le az állam a termodinamikai rendszer.
Az egyenlet vonatkozik a makroparamétert egy adott gáz (nyomás. Kötet és a hőmérséklet), hogy a tömegét.
P - Nyomás (Pa) V - mennyiség () T - abszolút hőmérséklet (K) m - tömeg (kg) # 120641; - moláris tömege (kg / mól)
# 120642; - anyagmennyiség (mol) R - az univerzális gázállandó R = 8,31 J / Molkov
Ez az egyenlet írja le az állam a termodinamikai rendszer egy állandó tömegű gáz.
Az egyenlet vonatkozik a makroparamétert egy adott gáz (nyomás. Kötet és hőmérséklet) állandó tömegig szárítjuk.
- Nyomás (Pa) - Volume () - abszolút hőmérséklet (K) - A gáz nachalnomsostoyanii
- Nyomás (Pa) - Volume () - abszolút hőmérséklet (K) - a végső állapotban gáz
=
Izoprotsessy gázokban.
Izoprotsess - az a folyamat, amelyben az egyik makroszkopikus paramétereinek az állam egy adott tömegű gáz állandó marad.
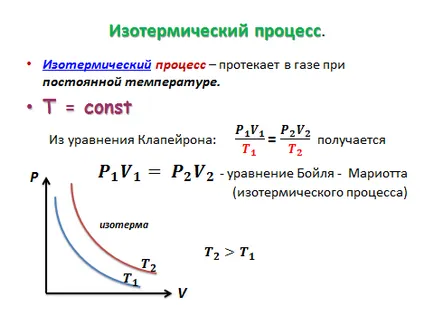


Jegy № 9. A párolgás és kondenzáció. Telített és telítetlen pár. Relatív nedvességtartalma a levegő és mérése.
Ezzel szemben az ideális gáz, gáz pillanatnyi nem teljesen engedelmeskedik Boyle-törvény: az első kompressziós növeli a nyomást, majd elfolyósodik állandó nyomás, akkor a hangerő nem csökken.
Bepárlás - az átmenet a molekulák egy folyadék gáz halmazállapotban. Ez történik az energia elnyelését.
Kondenzáció - az átmeneti rész a gázmolekulák a folyadék térfogata. Ez történik az energia felszabadítását.
Dinamikus egyensúly - olyan állapot, amelyben a számot egyenlő a molekulák számának bepároljuk prokondensirovavshih.
Telített gőz - dinamikus egyensúlyban annak folyadék. A telített gőznyomás függ csak a hőmérséklet. Mintapéldák folyadékot zárt tartályban.
Telítetlen pár - nyomás alatt alatti telített gőz nyomása. Példa - a folyadékot egy nyitott edényben.
Forráspont - a folyadék elpárolgása mennyiség. Forráspont kezdődik, ha a nyomás a gázbuborék egyenlővé válik a légköri.
A forráspont függ a környezeti nyomás. A növekvő nyomás a forráspont emelkedik, és fordítva.
páratartalom - abszolút és relatív.
Nedvesség - száma vízgőz 1 m 3 levegő. (Azaz, parciális nyomás).
Relatív páratartalom - aránya a parciális nyomásnak a telített gőz nyomása, százalékban kifejezve.
P - parciális nyomása (Pa) Ph - telített gőz nyomása (Pa) - relatív páratartalom (%)
A parciális nyomás - a nyomás része a gáz van jelen a gázkeverék.
Relatív páratartalom mérjük higrométer.
Nedvességmérő - haj, csatlakozik egy nyíl, amely megváltoztatja a hosszát, attól függően, hogy a páratartalmat.
Higrométer - két hőmérő, az egyik hőmérsékletét méri száraz levegő és nedvesített más. A különbség a száraz-és nedves hőmérők és Psychrometric táblázat határozza meg a relatív páratartalom.