Kaloriméter - Ingyenes online enciklopédia - Enciklopédia és Szótár
Kaloriméter (a latin calor -. Hő és mérő.)
mérésére szolgáló eszközt a felszabaduló hőmennyiség, illetve szívódik bármilyen fizikai, kémiai vagy biológiai eljárással. A "K" volt által javasolt Lavoisier és Laplace, P. (1780).
K. Modern működik a hőmérséklet-tartományban 0,1-3500 K, és lehetővé teszi, hogy mérjük azt a hőmennyiséget, legfeljebb 10 -2%. K. A készülék igen rugalmas és természetétől függ, és az eljárás időtartama alatt tanulmány, a hőmérséklet tartomány, amelyben a mérést végzünk, a hőmennyiség mért és a szükséges pontosság.
K. mérésére tervezett teljes hőmennyiség Q. során felszabadult ez az elejétől a végéig nevezik K. integrátor; K. mérési hőteljesítmény L és változásai különböző szakaszaiban - a fogyasztásmérőt vagy K-oszcilloszkóp. A konstrukcióban a kaloriméter mérési rendszer és módszer különböztetni folyékony és masszív K. egyszeres és kettős (eltérés).
Folyékony K. integrátor változó hőmérsékleten (ábra. 1), hogy az izotermikus Shell mérésére alkalmazott hő az oldódási és a hő a kémiai reakciók. Ez egy hajó egy folyadékkal (általában víz), amelyek: a kamra tartására a vizsgálati folyamat ( „bomba kaloriméter”), keverővel, melegítő és hőmérővel. A felszabaduló hőt a kamrában, majd megosztjuk a kamra és a másik közeg. K. részből, amelyek együtt nevezzük kaloriméter műszerrendszer. Az állapotváltás (például hőmérséklet) kalorimetriás rendszer méri a hőmennyiség bevezetett K. A fűtési rendszer rögzített kaloriméter hőmérő. A mérések előtt van kalibrálva K. - határozza meg a hőmérséklet változásának a kaloriméter rendszer közlésével egy bizonyos mennyiségű hő (K. fűtő vagy eredményeként a kémiai reakció kamrát egy ismert mennyiségű standard anyag). Ennek eredményeként, a kalibrációs értéket K abból áll megszerzése termikus m. E. együtthatóval kell szorozni a mért hőmérséklet-változás K. hőmérővel, hogy meghatározzuk azt a hőmennyiséget, bele. A termikus értéke a K a hőkapacitás (c) kalorimetriás rendszer. . Meghatározása az ismeretlen égéshő vagy kémiai reakció, stb Q csökkenti a hőmérséklet-változás At kalorimetriás mérési rendszer által okozott eljárással vizsgáltuk: Q = c .Δt. Jellemzően Q érték említett súlya anyagról a kamrában K.
A kalorimetriás mérések lehetővé teszik, hogy közvetlenül meghatározza csak a hőmennyiség a vizsgálati folyamat és a különböző másodlagos eljárásnak, mint például a keverés, a víz elpárolgását, az anyaggal ampulla törés, stb Hő oldali folyamatokat kell meghatározni kísérleti úton vagy számítással, és kizárják a végeredményt. Az egyik folyamatok elkerülhetetlen oldalán K. Hőátadás a környezettel hősugárzással és hővezetéssel. Annak érdekében, könyvelési oldali folyamatok elsősorban hőcserélő rendszer kalorimetrikus térhatású shell, melynek hőmérséklete szabályozható.
Az izotermikus folyékony K. shell hőmérsékletet állandó értéken tartjuk. Annak megállapítására, a kémiai reakció melegíti a legnagyobb nehézségek gyakran jár együtt nem veszi figyelembe a másodlagos folyamatok, és a meghatározást a reakció teljessé tétele és annak szükségességére, hogy figyelembe vegyék több reakciót.
VK-integrátor másik fajból - izoterm (állandó hőmérsékletű) fent megadott a hő nem változik a hőmérséklet a kalorimetriás rendszer, és változást okoz a aggregált állapotban a test, részét képező rendszer (például, az olvadó jég a jég Bunsen kaloriméter). A szám a bevezetett hő kiszámítása ebben az esetben tömeg anyag, amely megváltoztatta aggregációs állapotától (például súlya olvadt jeget, ami mérhető változás térfogatarányú elegyét jég és víz), és a hő a fázisátalakulás (lásd. A hőt a fázisátmenet).
Massive K. integrátor a leggyakrabban használt, hogy meghatározzuk a entalpia (Lásd. Entalpia) anyagok magas hőmérsékleten (2500 ° C). K. kaloriméter ilyen típusú rendszer egy blokk, amely fémből (jellemzően vörösréz vagy alumínium) mélyedésekkel a reakcióedényt, amelyben a reakció lejátszódik, hőmérővel és fűtő. A entalpiája anyag kiszámítani a termék a hő értéke K a különbség blokk hőmérséklete mászik után mért csepegés a foglalatba egy bizonyos összeget ampullák anyagot, majd az üres ampulla, melegítjük ugyanezen a hőmérsékleten.
A hőkapacitású gázokat, és néha folyadékok, meghatározott m. N. K. labirintust áramlás - a hőmérséklet-különbség a bemeneti és kimeneti a folyadékáramlási vagy stacionárius gázáram, és a teljesítmény a Joule hő, egy dedikált elektromos fűtés K.
K. meghatalmazotti fogyasztásmérőt, szemben a K-integrátor jelentős hőátadást bemeneti a hőmennyiség gyorsan eltávolítjuk, és a feltétele a K által meghatározott pillanatnyi értéke a teljesítmény a termikus eljárással. Hőenergia az a folyamat, hogy a hőcsere a K héj. Az ilyen K. (ábra. 2) fejlesztette ki a francia fizikus E. Calve (Ye Calvet, 1895-1966), egy fém tömb csatornák, amely kerülnek a hengeres sejtben. A cellában, a folyamat alatt vizsgálatot lefolytatják; fémblokkba szerepét játssza a héj (a hőmérsékletet állandó értéken tartjuk pontossággal 10 -5 -10 -6 K). A hőmérséklet-különbség által mért elemi cellát és termofil, amelynek 1000 csomópontok. Hőcserélő elem elektromotoros erejének és a kis hőelemből arányos a hőmérséklet-különbség között fellépő az egység és a sejt, amikor a felszabaduló hő vagy abszorbeálja. A blokk kerül többnyire két sejt működik, mint egy differenciális hőelemből K. minden cellában azonos számú csomópontok, és ezért azok a különbség lehetővé teszi az EMF közvetlenül határozza meg a különbség a hőkapacitása fluxusok belépő a sejt. Ez a módszer elkerüli torzítás mérések mérendő véletlenszerű ingadozásokat blokk hőmérséklete. Minden sejt jellemzően szerelt két termofil: lehetővé teszi, hogy az egyik, hogy kompenzálja a hőteljesítmény a vizsgálati folyamat alapján a Peltier-hatás, és a másik (indikátor) mérésére használjuk egy kompenzálatlan része a hő áramlását. Ebben az esetben, az eszköz működik, mint egy eltérés kompenzációs K. Szobahőmérsékleten, az ilyen termikus kapacitása K. mért folyamatok legfeljebb 1 mW.
Hagyományos neve K. - „kémiai reakció”, „bomba”, „izoterm”, „jég”, „alacsony hőmérsékletű” - vannak, a történelmi indulási és elsősorban a módszer és körét használat K. nem teljesek és nem komparatív jellemző .
K. általános besorolását lehet kialakítani alapján a figyelmet a három fő változók, amelyek meghatározzák a mérési módszer: kalorimetriás Tc hőmérséklete a rendszerbe; Ahhoz, hogy a héj hőmérsékletét. Környezeti kalorimetriás rendszer L. mennyiségű hő szabadul fel K. egységnyi idő (a hőkapacitása).
C. állandó Tc hívásához izotermikus; A Tc = A - adiabatikus; C. működő állandó hőmérséklet-különbség a Tc - To. K-nak nevezett állandó hőátadási; a izoperbolikus K. (ez az úgynevezett K. izoterm Shell) állandó To. és Tc a hőkapacitása funkció L.
Fontos befolyásoló tényező a végeredmény a mérések megbízható munkája automatikus hőmérséklet szabályozás izotermikus vagy adiabatikus kagyló. Az adiabatikus K. shell hőmérséklet szabályozását úgy, hogy mindig közel van a változó hőmérséklet kaloriméter rendszer. Adiabatikus Shell - könnyű fém ernyő kidolgozását, amely egy fűtőelem - csökkenti a hőátadást, így, hogy a K. hőmérséklete változik csak néhány tízezred fok / perc. ez gyakran csökkenti a hőátadás során kalorimetrikus kísérlet jelentéktelen érték, ami elhanyagolható. Ha szükséges, az eredmények közvetlen méréseket korrigáltuk a hőcserélő, a számítási módszer, amelynek alapja a Newton hőátadás - hőáramlás közötti arányosság K és köpeny különbség a hőmérséklet, ha a különbség kicsi (3-4 ° C).
K. izotermikus héj hő kémiai reakció lehet meghatározni pontossággal legfeljebb 0,01%. Ha a méretek K. kicsi, annak hőmérséklete változik több mint 2-3 ° C és a folyamat hosszú, akkor az izotermikus borítékot korrekció hőcserélő elérheti 15-20% a mért érték és súlyosan korlátozza a mérés pontosságát. Ezekben az esetekben célszerűbb használni adiabatikus shell.
Adiabatikus K. meghatározására fajhő szilárd és folyékony anyagok a 0,1 és 1000 K Szobahőmérsékleten és alsó adiabatikus K. védett vákuum köpeny elmerül a Dewar-edény (Lásd. Dewar) folyadékkal töltött hélium-, hidrogén- vagy nitrogén (ábra. 3). Megemelt hőmérsékleten (100 ° C feletti) helyezünk egy termosztatikus K. elektromos kemence.
Lit.: Popov M. M. hőmérsékletmérő és Calorimetry, 2nd ed. Moszkva, 1954; Skuratov SM KOLOSOV VP Vorobev A. F. termokémiai, 1-2 óra, M. 1964-1966 .; Calvet E. Prat A. Micro-kalorimetriával, transz. Franciaországgal. M., 1963; Kísérleti termokémiai, v. 1-2 N. Y. - L. 1956-62.
Ábra. 1. Folyékony kaloriméter integrátor izoterm héj (rendszer): 1 - „bomba kaloriméter”; 2 - fűtés a gerjesztés a reakció; 3 - ténylegesen kaloriméterrel (teli edénybe vízzel); 4 - ellenállás-hőmérő; 5 - Hűtőszekrényben (a cső, amelyen keresztül hideg levegőt továbbítani lehet); 6 - izoterm kaloriméter héj töltve vízzel; 7 - fűtő köpeny; 8 - kapcsolati hőmérő hőmérséklet beállítása burkolat; 9 - ellenőrző hőmérővel; 10 - egy mechanikus keverővel.
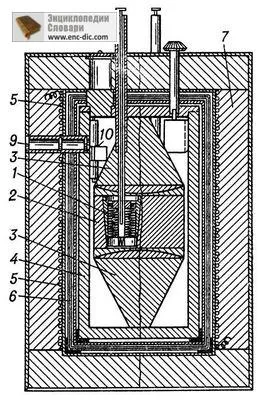
Ábra. 2. E. Calvet mérő kaloriméter hőteljesítmény folyamatok (reakcióvázlat) 1 - kalorimetriás sejt hőelemekkel; 2 - kaloriméter blokk; 3 - fém kúpok, hogy egyenletes hőmérsékletet hozzunk létre a mező a blokkban; 4 - héj; 5 - fűtőberendezést hőmérséklet-szabályozó készüléket; 6 - hőpajzsok; 7 - hőszigetelés; 8 - a cső bevezetésének egy anyagnak a kaloriméter; 9 - ablak mintavétel a galvanométer 10.
Ábra. 3. adiabatikus kaloriméterben mérik, hogy meghatározzuk a hőkapacitás alacsony hőmérsékleten (reakcióvázlat) 1 - kaloriméter (egy - egy hajót az anyag, - egy ellenállás-hőmérő, a - fűtő); 2 - adiabatikus héj (képernyő); 3 - vákuum zakó; 4 - egy cső szivattyúzására; 5 - cső elektromos vezetékek.
Nagy Szovjet Enciklopédia. - M. szovjet Encyclopedia 1969-1978