Kémiai kinetika 2
Kémiai kinetika ─ a tanítás a törvények a kémiai reakciókat. Kinetikai fontolgatja két fontos és egymással összefüggő jellemzőit reakciók sebességét és mechanizmusát, a tudás, amely lehetővé teszi, hogy ellenőrizzék reakciók, válasszuk ki az optimális feltételeket, az előfordulás.
2.1 A kémiai reakciók sebességének
az arány a kémiai reakció határozza meg az ütközések száma reagáló aktív részecskék előforduló egységnyi idő egységnyi térfogatra (homogén reakció), vagy az interfész egység (heterogén reakciók), kialakulásához vezet egy új kémiai reakció sebessége veschestva.za fogadja a változás a moláris koncentrációja az anyag egységnyi idő és egységnyi reakció-térfogat. Így lényegtelen, ami a reagensek dönt, hogy figyelemmel kíséri a sebességet, mivel vannak összekötve egy reakcióegyenlet. Például, a moláris koncentrációja a reaktáns egy időben τ1



moláris koncentrációja megmutatja, hogy hány mól szereplő anyag 1 liter oldat vagy gáz keverék térfogatot, időt másodpercekben mérjük.
Kiszámításához a reakció sebessége, meg kell tudni, hogyan kell változtatni a koncentráció egyik reagens egy adott ideig. Minél kisebb az időintervallum, kísérletileg talált minél közelebb a valódi sebesség, t. E. hogy a sebesség az adott pillanatban. A reakció sebessége mindig pozitív, így a szedett frakciót a mínusz jel abban az esetben, ha tanulmányozza a koncentráció-változását a kiindulási anyag a reakció (
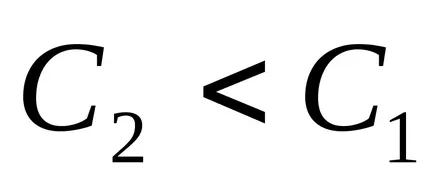
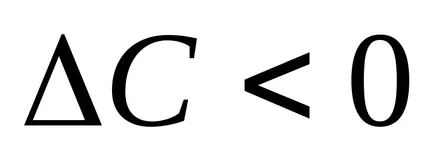
A reakciós ráta meghatározásához a folyamat lehet megválasztani, hogy a megjelenése egy bizonyos mennyiségű termék van rögzítve vizuálisan, például, megszerzése csapadék. Így, az időintervallum a pillanatától elvezetését megoldások, amíg a csapadék fordítottan arányos a reakció sebessége, így 1 /

ahol

nyomás (abban az esetben, képződésével járó reakciókat gázt, mivel a koncentráció változik nyomás);
a mértéke őrlés reakciókban szilárd anyagok.
2.2 függése a reakciósebesség a koncentrációt. Tömeghatás törvénye
Ez a függőség megnyílt két norvég kutatók - Guldberg és Waage 1867 éve és magyar tudósok Beketovym és az úgynevezett tömeghatás törvénye: állandó hőmérsékleten a kémiai reakció sebessége egyenesen arányos a termék koncentrációjának, a reagensek, egyesítjük egy foka egyenlő az együttható az anyag a reakció egyenletben.
A reakció aA + bB = mM + nN tömeghatás törvénye a következő alakú:
ahol



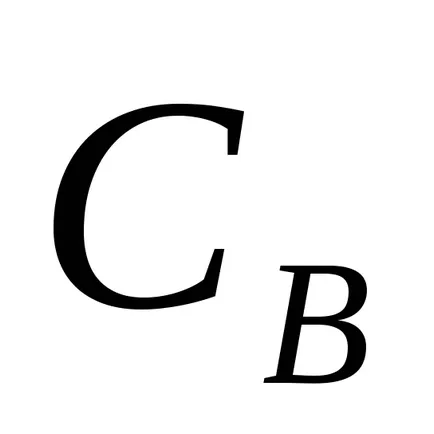
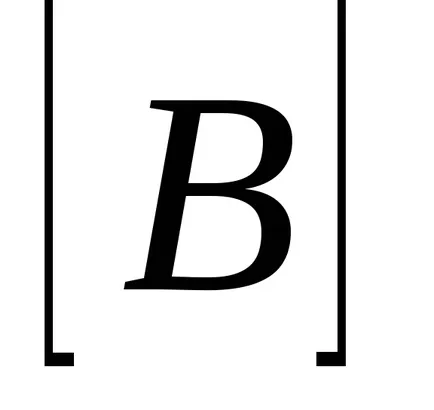
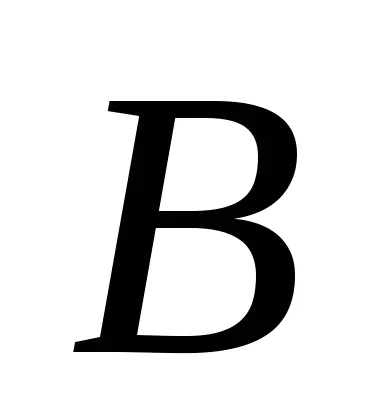

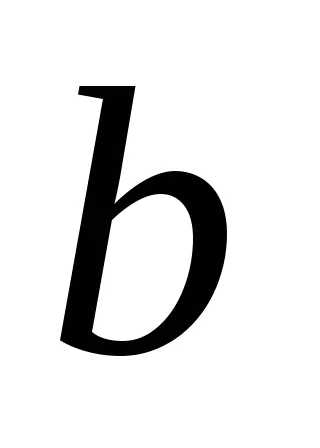
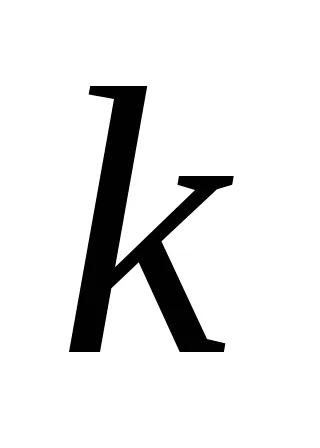
Ha feltételezzük, hogy

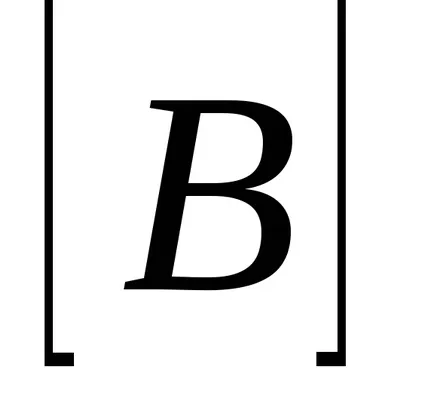
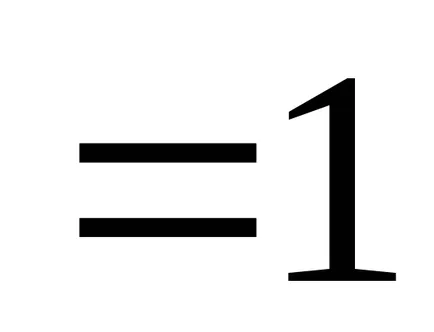
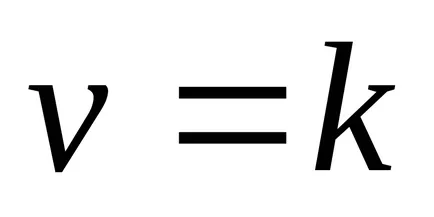
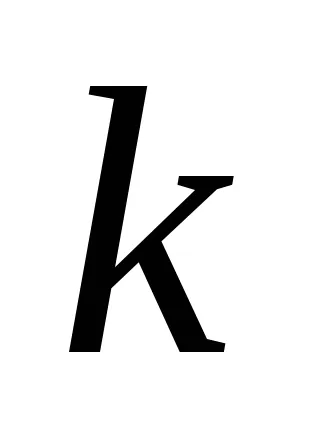
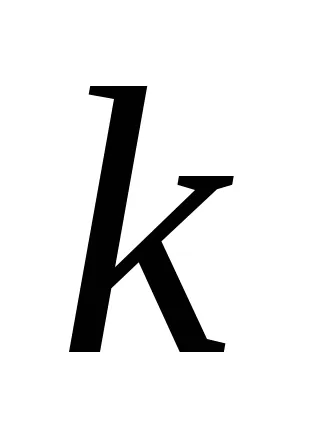
Tekintsük a példa egy homogén kémiai reakció: