kémiai re
katalizátor nagy jelentősége van az ipari megvalósítása katalitikus eljárások.
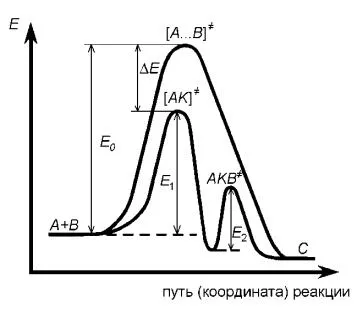
5. Amikor a pozitív katalízis a katalizátor csökken az aktiválási energia a reakció. Ez annak a ténynek köszönhető, hogy az aktiválási energia a kialakulásának közbenső komplexek a katalizátor a kiindulási reagensek és a kialakulását Ezek a reakciótermékek általában sokkal alacsonyabb, mint az aktiválási energia a nem-katalitikus reakció.
Az ábra (8.1) képviseli a rendszer energia változás a katalitikus és nem katalitikus bimolekuláris reakciót
Ábra - 8.1 változása potenciális energia homogén katalitikus és nem katalitikus reakciók
A katalizátor távollétében, a mechanizmus lehet képviseli
Csökkentése az aktivációs energia E A felel meg (általában
Az utolsó egyenlet következő néhány fontos következtetéseket:
1. A reakció sebessége arányos a kezdeti koncentráció a katalizátor C 0 K.
2. Általában a sorrendben a reakció lesz frakcionált.
3. Ha C A K pavn. »1, majd υ = k 3 K 0 C-on és a reakcióelegyet válik nulladrendű reakciót a kiindulási anyag A. Ez azt jelenti, hogy az összes katalizátor komplex van csatlakoztatva a közbenső és a reakció sebessége határozza meg a számát.
4. Ha a C A K pavn. «1, majd υ = K 3 K o C A C 0 ° C és a reakció elsőrendű reakció a kiindulási anyag; n A = 1.
Így, a sorrendben a reakció függ a reagens koncentrációk (kiindulási anyag). Ez a funkció csak rendelkeznek katalitikus reakció.
8.4 heterogén katalízis
Heterogén katalízis szempontjából döntő fontosságú a modern vegyipar egyes becslések szerint akár 70% -os kémiai használatával előállított termékek geterogennokataliticheskih folyamatokat. Mint a későbbi példák szintézise kénsav alapuló katalitikus oxidációja a kén-oxid (IV) SO 2 kén-oxid (VI) SO 3 egy platina-vanádium katalizátor (Pt, V 2O 5); ammónia szintézisénél a hidrogén és a nitrogén a vas katalizátorok reklámozott oxidok kálium, alumínium; oxidációja ammónia a nitrogén-oxidok a platina-katalizátorok (salétromsav) és mások.
Mivel a heterogén katalízis, a katalizátort képez egy külön fázist és katalitikus folyamatok zajlanak a felületén (fázishatár), majd nagy szerepet során
heterogén katalitikus reakciók játssza folyamatok anyagátadási. Jellemzőjük minden tulajdonságával, hogy figyelembe vették a tanulmány a heterogén kémiai reakciók, azaz a folyamatot korlátozhatja egyik szakaszban zajlik, és a diffúziós, vagy kinetikus átmeneti tartomány. Jelenleg úgy gondoljuk, határozottan megállapítható, hogy a katalitikus hatása révén kémiai kölcsönhatás lép fel a szakaszban reaktánsok a katalizátor felületén vagy annak egyes részeit, az úgynevezett aktív helyeket. A szerepe az aktív centrumok gyakran játszanak kiemelkedések és a bordák a kristályos fázis a katalizátor felületére, kristályhibák, stb
Általában heterogén katalitikus folyamatokat lehet osztani a következő lépéseket:
1. A diffúziós prekurzorok oldatból vagy a gázfázisban, hogy a katalizátor felületén,
2. adszorpciója molekulák a kiindulási anyagok a katalizátor aktív centrumok, a vegyi és elektrosztatikus erők valamilyen formában intermedier:
3. aktiválása adszorbeált állapotban (a szükséges energiát ez az igazi energia aktiválás):
4. A szétesési aktivált komplex kialakulását
adszorbeált reakció termékek:
5. A deszorpciós reakció termékek a katalizátor felületéről.
6. A diffúziós a termékek a katalizátor felületi reakció. Mivel a heterogén fázisú katalitikus reakció lejátszódjon között
adszorbeált aktív helyeinek a molekulák, a sebességi egyenlet ilyen reakciók felületi koncentrációja reagensek. Például, a hidrogénezés az etilén a réz katalizátor között történik adszorbeált etilén és hidrogén molekulák:
C 2H 4 (hirdetéseket.) + H 2 (hirdetéseket.) = C 2 H 6.
és a reakció sebessége arányos a termék a felületi koncentráció:
kísérleti tény, mint a katalizátor-mérgezés rendkívül kis mennyiségű mérgek, amely teljesen elnyomja a katalizátor aktivitását.
Sajátossága heterokatalitikus folyamatok az a képessége, hogy a katalizátor-mérgezés és a promóció.
Promotion - növeli a katalizátor aktivitását jelenlétében anyagok, amelyek önmagukban nem katalizátorok erre a folyamat (promoterek). Például, a nikkel-fém-katalizált reakcióban
CO + H 2 -> CH 4 + H 2O
beadunk egy nikkel katalizátor cérium némi szennyeződést vezet hirtelen megnő a katalizátor aktivitását.
Mérgezés - éles katalizátoraktivitás csökkenése jelenlétében bizonyos anyagok (az úgynevezett katalitikus mérgek ..). Például, az ammónia szintézis reakcióban (katalizátor - vasszivacs) van jelen a reakcióelegyben, oxigén- vagy kéntartalmú vegyületek okoz drámai aktivitásának csökkenése a vas katalizátor; ugyanakkor a képességét adszorbens katalizátor prekurzorok csökken nagyon kicsit.
A fő kortárs elméletek heterogén katalízis a multiplet elmélet és az elmélet az aktív együttesek.
Multiplett elmélet. Ezen elmélet szerint az aktív helyet a gyűjtemény több adszorpciós helyek a katalizátor felületén. A adszorpciós reakciójával molekulák kialakult komplex multiplett az aktív helyen, ahol a kommunikáció újraelosztását és képződik reakciótermékek. Adszorpciós zajlik elvei szerint a geometriai és energetikai megfelelés.
ÖSSZEFOGLALÁS geometriai levelezés, hogy az elrendezés az erő a multiplett központban kell felelnie a helyét a atomok az adszorbeált molekulában.
Elve szerint a hatalom megfelelő, optimális összetétele a katalizátor eleget tesz az egyenlőség, a képződési energiája és pusztítás komplex multiplett. Túl gyenge és túl erős kölcsönhatást a reagensek és a katalizátor nem kívánatos.
Ahhoz, hogy megmagyarázni ezeket a funkciókat a heterogén katalitikus folyamatok G. Taylor a következő feltételezés: a katalitikusan aktív nem a teljes felületen a katalizátor, de csak néhány eѐ területeken - az úgynevezett aktív centrumban. amely lehet a különböző hibák a kristály szerkezete a katalizátor (például, kiemelkedések vagy bemélyedések az a katalizátor felületén). Jelenleg nincs egységes elmélet heterogén katalízis. multiplettek elméletet dolgoztak ki a fém-katalizátorok. A főbb rendelkezések az multiplett elmélet a következő:
1. Aktív katalizátor helyén van egy gyűjtemény egy bizonyos számú adszorpciós központok a katalizátor felületén összhangban geometriai szerkezetét a molekula átalakuló.
2. Amikor reagáltatunk adszorpciós molekulák kialakult komplex multiplett az aktív helyen, így a újraelosztása kötések képződését eredményező reakció termékek.
Elmélet multiplettek néha elmélet geometriai hasonlósága az aktív hely és a reagáló molekulák. A különböző reakciókat, száma adszorpciós központok (amelyek mindegyike azonosítható a fématommal) az aktív oldalon eltérő - 2, 3, 4, stb Az ilyen aktív helyek nevezzük, sorrendben, dublett, triplett, kvartett, stb (Általában m, és amely köszönheti a nevét az elmélet).
Elmélete aktív együttes. Ezen elmélet szerint, a katalitikus folyamat játszódik le atomcsoportot úgynevezett aktív együttese. Ellentétben multiplett elmélet, aktív együttes atomok nem elemei a kristályrácsban, és a katalizátor is vándorolnak belül szabadon egy meghatározott területen a katalizátor felületére. Migrációs korlátozza a lehetséges akadályok, amelyek fakadhat a mikroszkopikus repedések, a szennyezések jelenléte, inhomogenitása a szilárd felületre.
8.5 enzimatikus
Kivételes érték homogén katalízis veszi enzimatikus alapján az állati és növényi élet. Enzimek állnak teljesen vagy főként a fehérjék.
Enzimes katalízissel - a katalitikus reakciók zajlanak részvételével enzimek - biológiai katalizátorok protein jellegűek. Enzimatikus két jellemzője van:
1. Nagy aktivitás. több nagyságrenddel nagyobb, mint a szervetlen katalizátor miatt rendkívül jelentős csökkenése az energia az enzim aktiválását a folyamat. Így a sebességi állandó a bomlási reakció a hidrogén-peroxid által katalizált Fe 2+ ionok. 56 s-1; állandó sebessége ugyanazt a reakciót az enzim által katalizált kataláz, 3,5 × 10 7, azaz
Ahol K m - Michaelis-állandó. számszerűen egyenlő a szubsztrát koncentráció υ = ½ υ max. A Michaelis-állandó olyan intézkedés az affinitást a szubsztrát és az enzim: a kevésbé a m. A nagyobb, hogy képesek alkotnak egy enzim-szubsztrát komplex.

Ábra - 8.5 függése az enzim reakció sebességének a szubsztrát koncentráció
A jellemző az enzimek is rendkívül érzékeny enzimaktivitást a külső körülmények -
pH és hőmérséklet. Az enzimek aktívak csak egy meglehetősen szűk pH és a hőmérséklet, az enzim jelenléte jellemez ebben az intervallumban egy maximális aktivitás optimális pH és hőmérséklet; mindkét oldalán ezt az értéket, az enzim aktivitása gyorsan csökken.
Kinetikájának leírására enzimatikus reakciók alkalmazásával
Michaelis Menten egyenlet (8.20).
Tekintsük a kimenet a kinetikus egyenlet a homogén katalitikus eljárás Például ha a reagáltatást egy kiindulási anyag (szubsztrát) S. P, amelyet átalakítunk a termék jelenlétében K katalizátor (különösen egy ilyen katalizátor lehet egy enzim):
A fizikai jelentése ennek az egyenletnek, hogy magas koncentrációban, az összes katalizátor prekurzor szerepelnek a közbenső vegyületet KS. Koncentráció KS folyásánál
határértéket C K 0. Következésképpen, a termelésének mértéke
termék eléri a határérték egy adott mennyiségű katalizátor, jelöljük υ max.

Laboratóriumi munka №1
A tanulmány a sebesség inverzió nádcukor
Célkitűzés: tanulmányozása sebességének inverziós nádcukor, és kiszámítja a konstans inverzióját a reakció sebességét.
A inverziója nádcukor jelentése savval katalizált hidrolízis szacharóz, amelyek eredményeként kapott egyszerű cukrok: glükóz és fruktóz. Ez a reakció széles körben használják az ipari termelés. Reakció egyenlet formájában:
Ez a reakció gyakorlatilag visszafordíthatatlan, és annak mechanizmusa, ahogy a egyenletből, a bimolekuláris. Következésképpen eѐ sebesség lehet kiszámítani kinetikus egyenlet:
Azonban, a reakció vizes oldatban, ahol a víz koncentrációja jelentősen magasabb, mint a szacharóz koncentráció. Ezért, pazarlást vízmolekulák a reakcióban lehet elhanyagolni, és állandónak tekinthető a víz koncentrációja. majd
azaz bimolekuláris reakciót ténylegesen által leírt kinetikus egyenlet az elsőrendű reakció. Az ilyen reakciók említett nsevdonervogo rendelni reakciók, és a sebességi állandót lehet kiszámítani a következő egyenlet szerint
Molekulák valamennyi cukor, beleértve a szacharóz, a glükóz és a fruktóz tartalmaznak aszimmetrikus szénatom, aminek következtében optikai aktivitás és elforgatni képesek polarizáció síkja