Kiszámítása a változás az energia egy kémiai reakció standard hőmérsékleten Gibbs
A számítás a Gibbs energia változás a kémiai reakció standard hőmérsékleten (298 K) lehet hajtani a megfelelő referencia adatok variációk standard potenciálok az anyagok kialakulását
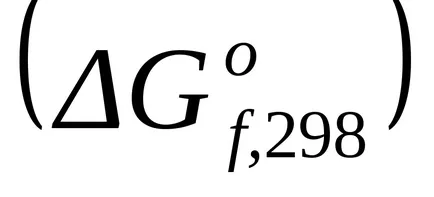
A szabványos Gibbs energia változás kialakulását egyszerű anyagok stabil nulla.
Egy másik módszer kiszámítására a standard eltérésből a Gibbs energia a kémiai reakció a használata a Gibbs-Helmholtz egyenlettel:
ahol T = 298 K;
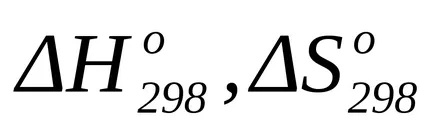
Kiszámítása a változás a Gibbs energia egy kémiai reakció egy nem szabványos hőmérséklet,
A számítás a Gibbs-féle szabad energia változás a kémiai reakció hőmérséklete általában termel szabálytalan át a Gibbs-Helmholtz egyenlettel:
ahol T - a reakció hőmérsékletétől;
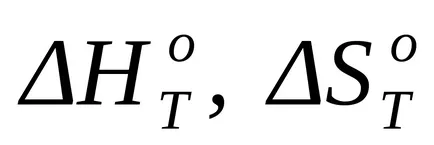
Amikor közelítő számítások használhatja a feltételezés, hogy a változások az entalpia és az entrópia hőmérséklettől független, és a számításokat alkalmazni az alapértelmezett értékeket, és az eredményeket a hőmérséklet 298 K:
ahol T - reakció-hőmérséklet, amelyre közelítő számítás elvégzése.
Hiányában a fázisátalakulások pontos kiszámításához a standard Gibbs energia változás hőmérsékleten T (
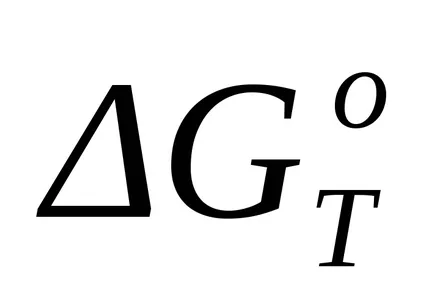
ahol T - a hőmérséklet, amelyen a reakció; Aa, Ab, Ac, Ac - az együtthatók megfelelő hatásköre kapott T kiszámításával ΔSP; Mo, M1, M2, M2 - együtthatók Aa, Ab, Ac, Ac illetve, hogy az előre meghatározott hőmérséklet értékét kézikönyvekben a megadott számítási módszer.
Példa Példa 1.15. Számítsuk ki a közelítő és a pontos változás a Gibbs energia a kémiai reakció T = 298 K és T = 1800 K és meghatározza a lehetőségét annak előfordulása az adott hőmérsékleten:
Szükséges referenciaadat táblázatban mutatjuk be. 1.10.
Egy szabványos termikus hatás, mint az entalpia változás a ismert futamot általános képletű vegyületek képződése (1,17):
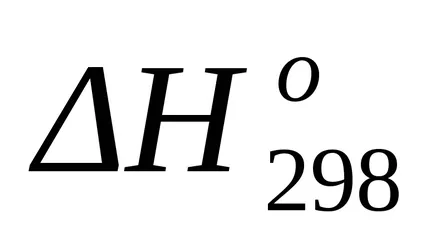
A szabványos entrópia változás a képlet (1,38):
A szabványos Gibbs energia változás T = 298 K A find
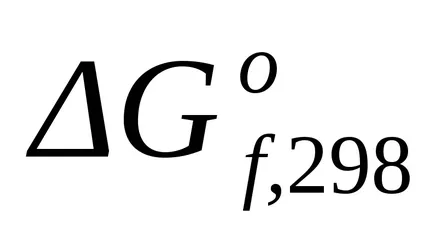
A szabványos Gibbs energia változás T = 298 K is egyenlet szerint számítjuk ki (1,43):
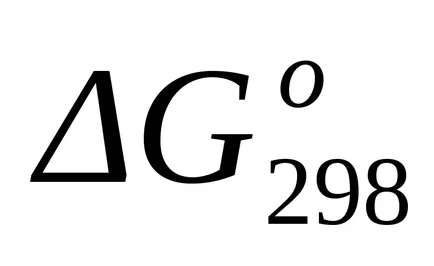
A szabványos Gibbs energia változás a T = 1800 K megtalálják a közelítő általános képletű (1,46):

Mivel hőmérsékleten 298 K és 1800 K
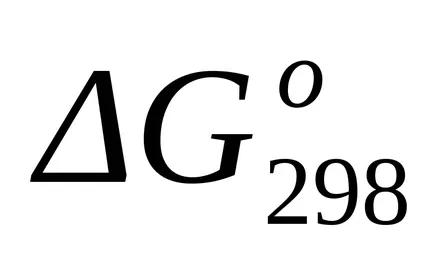
A pontos számítási
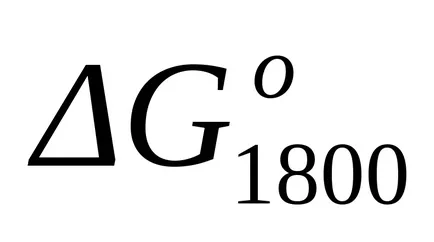
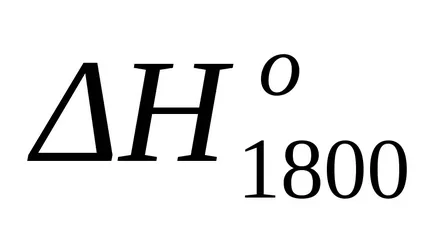
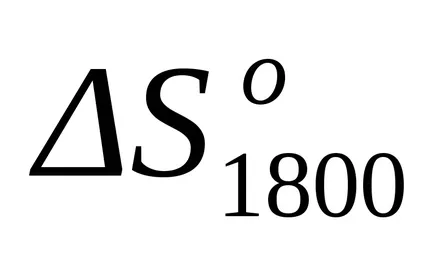
Aa = (25,02 + 2 × 30,00) - (62,86 + 2 × 27,28) = - 32,40;
Egyenlet hőkapacitás függően változik a hőmérséklet helyettesítése után, a talált értékek Aa, Ab, Ac lesz formájában:
A helyettesítés után ennek az egyenletnek a képlet (1,25) és a (1.39) kiszámítja entalpia változások és entrópia változások a reakciót T = 1800:

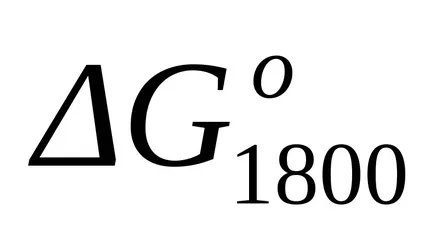
Mivel az érték a Gibbs energia változás eredménye
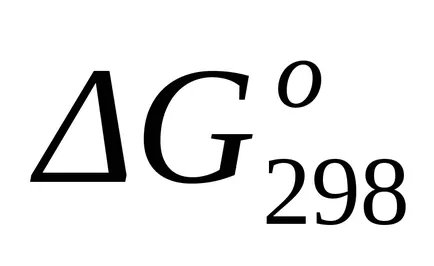
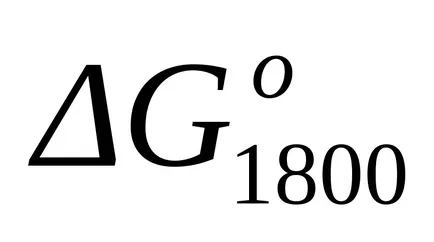
Példa Példa 1.16. Számítsuk ki a változás Gibbs szabad energia a kémiai reakció példa 1,15 T = 1800 K módszerével a Temkin-Shvartsman.
Számítás szerint végeztük képletű (1,47) való hivatkozással ezt a reakciót, amelyben minden résztvevő szervetlen anyagok:
Mn értékeket veszünk referencia együtthatók egy előre meghatározott hőmérséklet 1800 K:
érték
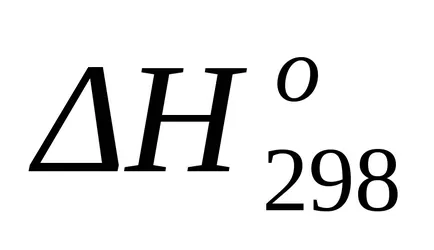
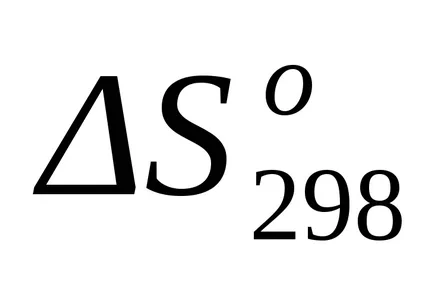
Találunk a változás a Gibbs energia a reakció T = 1800 K: