Körkörös folyamatok (ciklus)
Az a folyamat, amelyben a rendszer, áthalad egy sor állam, visszatér az eredeti állapotot nevezik kör vagy folyamat során. A diagram ábrázolt folyamat ciklus zárva van (7. ábra) a görbe.
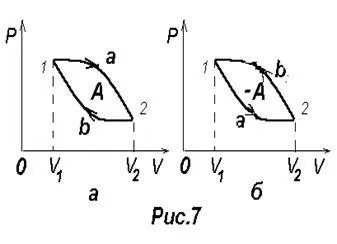
A ciklus lehet osztani a folyamat tágulás és összehúzódás 1-2 2-1. Munka bővítése által meghatározott terület 1. ábra 1a2V2 V1 pozitív, hiszen dV> 0. kompressziós munkát amely által meghatározott területen a 2. ábra 2b1V1 V2 negatív, hiszen dV <0. Следовательно, работа, совершаемая газом за цикл определяется площадью,
által lefedett zárt görbe.
Ha a ciklus a pozitív munka (a ciklus folytatódik az óramutató járásával megegyező irányban), ez az úgynevezett közvetlen (7. ábra, A). Ha a ciklus negatív elvégzett munka (ciklus folytatódik óramutató járásával ellentétes irányban), ez az úgynevezett inverz (7. ábra b). Abban az esetben, fordított ciklus külső test végre pozitív munkát a gáz - kompressziós munkát a gáz A ¢. A gáz ebben az esetben nem negatív munkahelyi A = -A ¢.
Közvetlen ciklus használt égésű motorok - időszakosan működő motorok elkövetni művelet átvétele a külső hővel.
Fordított ciklus használt hűtőszekrényekben - periodikusan meglévő berendezések, amelyekben történő működése következtében a külső erők, a hő átadódik a test magasabb hőmérsékleten.
Ennek eredményeként, a körkörös folyamat, a rendszer visszatér az eredeti állapotába, és így a teljes változás a belső energia a gáz DU nulla. Ezért, PNT (4) a ciklikus folyamat: Q = DU + A = A. azaz munkát ciklusonként egyenlő mennyiségű hőt kapott kívülről. Mindazonáltal, ennek eredményeként a körkörös hőerőgép folyamat, hogyan kell megszerezni, és így, tehát A = Q1 -Q2. ahol Q1 - hőmennyiséget rendszer által kapott, Q2 - kolichetvo hőt adott rendszerben. hatékonysági arány a ciklikus folyamat
Termodinamikai folyamatot nevezzük visszafordítható, ha ez előfordul mind az előre és hátra irányban, így a rendszer visszaáll az eredeti állapot, és a környezetben, és ebben a rendszerben nincs változás. Például, csillapítatlan rezgések. Megjegyezzük, hogy az egyensúlyi folyamatok is nevezik visszafordítható.
Bármely folyamat, amely nem felel meg ezeknek a feltételeknek nevezzük visszafordíthatatlan. (Megjegyezzük, hogy az összes folyamatot kíséri súrlódás, irreverzibilis).
Carnot ciklus 8. ábrán bemutatott, ahol izotermikus expanzió és a kompresszió által adott görbék 1-2 és 3-4, az adiabatikus tágulás és összehúzódás - a görbék 2-3 és 4-1.
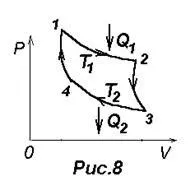
Szerint (23) a hatékonysága a Carnot-ciklus, H = A / Q = (Q1 -Q2) / Q1 = 1- Q2 / Q1. ahol Q1 - mennyiségű hő által termelt gáz fűtés, a hőmérséklet T1. Q2 - kolichetvo hőt adott gáz hűtő, a T2 hőmérséklet. Carnot megmutatta, hogy ez a ciklus h = (Q1 -Q2) / Q1 = (T1 -T2) / T1 = 1, T2 / T1. (24), azaz Hatékonyság esetben csak egy melegítő és hűtő hőmérsékleten. Carnot feltételezzük, hogy ez az eredmény érvényes minden termodinamikai rendszereket.
Fordított Carnot-ciklus az alapja az intézkedés hőszivattyúk. A hőszivattyúk kell annyi hőenergiát a lehető, hogy egy meleg test, mint például a fűtési rendszer. A legtöbb ez az energia venni a környezet alacsony hőmérsékleten és egy alsó része - úgy kapjuk meg, a mechanikai megmunkálással együtt eredményezi, például egy kompresszor.
4.10.1. Az entrópia termodinamikai
Tanulmányozása közben PNT () megállapította. hogy Du egy teljes eltérés (ismert matematikai, hogy dU eltérés teljes, ha az integrál független útvonal az integráció, és különösen, a szerves mentén zárt pályán, vagy loop L = 0), és dQ dA és eltérések korántsem teljes.
A matematika az is ismert, hogy az összeg, amellyel meg kell szorozni egy kifejezést, hogy ez egy teljes eltérés, az úgynevezett integráló tényező. A termodinamika, ha bebizonyosodik, hogy egy reverzibilis folyamat ilyen integráló tényező 1 / T, és amikor dQ / T lesz a teljes eltérés mintegy még ismeretlen számunkra állami funkció S rendszer, azaz a dQ / T = dS. (25)
Így meghatározott állami funkció S termodinamikai entrópiája a rendszer hívás, akkor mérjük J / K. Tól (25) azt látjuk, hogy DS és a dQ vannak azonos előjelű. Ez lehetővé teszi, hogy módosítsa a természet entrópia megítélni az irányt a hőátadás folyamatában. A koncepció az entrópia-ben vezették be 1865-ben Clausius.
POT (8) egy ideális gáz tetszőleges m tömegű a képlet U = (i / 2) nRT = NCV T. CV = (i / 2) R, PV = nRT (n = m / M - móljainak a száma), és formáját ölti teljes eltérés entrópia
Mivel az ideális gáz állandó tömeg PV / T = const. az
LNP + LNV -lnT = const. és d LNP + d LNV -d LNT = 0, és (26) egyenlet felírható két ekvivalens formák vele
Ha a rendszer mozog 1 állapot, azzal jellemezve P1 paramétereket. V1. T1. A 2. állapotban, azzal jellemezve, hogy a paraméterek a P2. V2. T2. változásának megfelelően az entrópia (26) - (28) DS = S2 -S1 = = n [CV ln (T2 / T1) + R ln (V2 / V1)] =
azaz Valóban DS = dQ / T a teljes eltérés állami funkció S - entrópia.
Mivel az adiabatikus folyamat dQ = TdS = 0. Ezután, következésképpen, DS = 0 és S = const. Így, egy reverzibilis adiabatikus folyamat egy izentropikus folyamat.
Képletek (26) - (29) lehetővé teszik, hogy össze egy termodinamikai diagram T-S. Lásd. 9. ábra. Legyen O pont képviseli a kezdeti állapot egy ideális gázt, majd
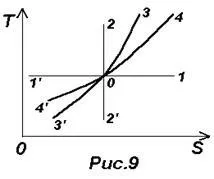
Izobár ábrázolt 4-4 vonal ¢. kiterjesztése tegye isochore ¢ 3-3 (0-4 - fűtés és bővítése, 0-4 ¢ - hűtés és tömörítés).
Így, az entrópia S lehet tekinteni, mint pontosan ugyanaz a paraméter, mint a másik három paraméter P, V, T. Csakúgy, mint egy ideális gáz állapotegyenlet PV = nRT lehet kifejezni, például T keresztül egyéb paraméterek P és V. és az expressziós ( 29) lehetővé teszi, hogy kifejezzék S más rendszerparamétereket P. V. és T.
4.10.2. Az entrópia kinetikai szempontból. A harmadik főtétele
Entrópia termodinamikai itt bevezetett, sikeresen használják a számítások termodinamika.
Amikor a folyadék megkeményedik, a molekulák a kristály foglalnak jól meghatározott helyzetben egymáshoz képest, úgy, hogy a rendellenesség ugrásszerűen csökken. Ennek megfelelően a megszilárdulás során felszabaduló hő és entrópia ugrásszerűen csökken. Az abszolút nulla hőmozgás teljesen leáll, így rendezetlenség is nulla. Ebben a tekintetben, az entrópia valamennyi anyag a T = 0 vesszük egyenlő nullával.
Elfogadása: entrópia valamennyi szerv egyensúlyi nullához, mint a hőmérséklet megközelíti a nulla Kelvin, azaz az úgynevezett harmadik főtétele vagy tétel Nernst-Plank (1906, 1910).
Az az elképzelés, entrópia, mint egy intézkedés zavar a rendszerben jól jellemzi a függőség nemcsak a hőmérséklet, hanem a méret és egyéb paramétereket a rendszer.
4.10.3. Entrópia egyensúlyi statisztikus fizika
A mélyebb értelmét entrópia kiderült statisztikus fizika: az entrópia kapcsolódó termodinamikai valószínűsége, hogy a rendszer állapotát. A termodinamikai valószínűség W rendszer állapotáról - a szám a módszereket, amelyek az adott államban a rendszer, vagy a számát makroszkopikus mikroállapotok végrehajtja ezt macrostate lehet végrehajtani. A definíció W³ 1. azaz termodinamikai valószínűsége nem veroyanost P matematikai értelemben (P £ 1).
Például egy mól oxigén macrostate megfelelő fizikai P = 1 atmoszféra, és a T = 300 K végezhetjük száma mikroállamok W =. Képzeld el, ez a szám egészen lehetetlen.
Boltzmann 1872 mutatja, hogy az entrópia a rendszer, és a termodinamikai valószínűsége kapcsolatos a következő képlettel
ahol k - a Boltzmann állandó. A fenti példában S = 200 J / K.