Lehetséges értékek kvantumszámok
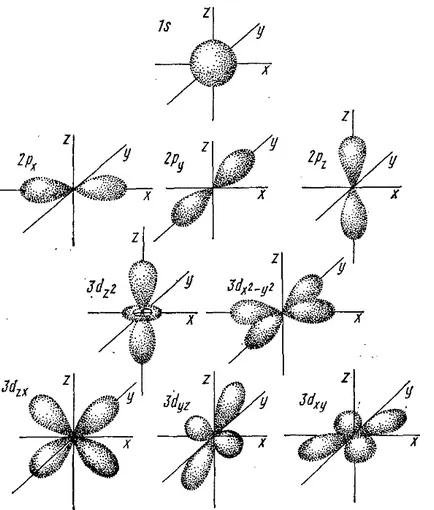
5. ábra. Az alakja az elektron pályák
A negyedik kvantumszám, az úgynevezett spin kvantumszám és jelöljük ms. Ez lehet két érték: +1/2 és -1/2. MS jellemzi saját perdület (perdület) egy elektron.
Kitöltése elektronok elektron pályák a sok-elektron atom
Schrödinger egyenlet lehetővé teszi, hogy pontosan kiszámítani az energia az elektron a single-elektron rendszert (hidrogénatom). Ahhoz, hogy atomok a fennmaradó elemeit, hogy az elektronikus pályák ugyanaz, mint a hidrogénatom, és a töltelék ezen pályák elektronokkal végezzük három elven: alacsony energia és Pauli Hund szabály.
Ez elfogadott a szerkezet a elektronhéjak atomok írott formában az elektronikus vagy elektronikus-grafikai formula. Amikor kitölti az elektronikus réteg atomok stacionárius (gerjesztett) állapotban tartjuk elve legkevesebb energia az elektron. amely szerint:
A legstabilabb állapotában a elektron egy atom megfelelnek a minimális a potenciális energia az elektron.
Ezért, a tölteléket az elektron rétegek kezdve szintek jellemzi a legalacsonyabb energia. Az elektron energia megnövekszik, amikor az összeg a tőke és orbitális kvantum számok (n + l) (első szabály Klechkovskii). Ha az értékek ugyanazon, az első elektron orbitális tele van egy kisebb értéket a főkvantumszám (második szabály Klechkovskii) (Fig.6) két pályák összege (n + l).
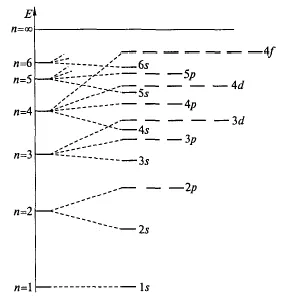
6. ábra. Változó energiájú elektron pályák
Az, hogy a kitöltő pályák az elektronok az alábbiak szerint:
1S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Alapelv (tiltás) Pauli
Az atom nem lehet két elektron azonos értékkel mind a négy kvantum számokat.
Ebből következik, hogy az egyes orbitális, azzal jellemezve, végleges értéket a fő N, L és az orbitális mágneses kvantumszámok ms nem lehet több, mint két elektron amelynek spin ellentétes előjelű lesz. Két elektronok ugyanabban orbitális (és azzal jellemezve, hogy ellenkező forog), a továbbiakban a párosított. A pörgetés egy irányban az úgynevezett párhuzamos és ellentétes irányú - antiparallel. Pauli-elv lehetővé teszi, hogy kiszámítja a maximális számú elektron minden energia szintet és szintalatti az atom (9. táblázat). A maximális az elektronok száma az szintalatti a orbitális kvantum szám 2 l (2l +1).
A szerkezet egyes elektron réteg értékétől függ a főkvantumszámú. Így a K-réteg (n = 1) áll, csak egy s-pályák; L-réteg (n = 2) tartalmaz, amelyek egy 2s-orbitális és három 2p-orbitális; M-réteg (n = 3) áll egy 3s-orbitális, három 3p-pályák és öt 3D-pályák, stb Elektronikus kapacitív réteget határozza meg a maximálisan N számú elektronok az elektron rétegben leírt általános képletű ..:
ahol n - a főkvantumszám.
Számított szerint ez a képlet a maximális elektronok száma minden egyes rétegben egyenlő: 1 réteg - 2, 2-réteg - 8, a 3-réteg - 18, a 4-réteg - 32 elektronok.
Helye a rétegek és az elektron pályák nevezzük az elektron konfiguráció (képlet). Amikor az elektronikus konfigurációs bejegyzések pontértéke a fő kvantum számot, majd - a betűk s, p, d, f - az orbitális kvantum számát, és a levelet a jobb felső - az elektronok száma ebben orbitális. A szekvenciát a töltés elektron pályák különböző elektronikus rétegek képviseletében a következő: