Mi affinitás kromatográfia, affinitáskromatográfia fajok
Az affinitás kromatográfia - egyfajta adszorpciós kromatográfia. A fő jellemzője a jelenléte egy affinitás kromatográfiás közötti komplementaritás az immobilizált ligandum a mátrix és egy második partnere pár interaktív komponensek, amely kivonjuk az elegyet más anyagokkal nem komplementer ligandum. Használata egy rendkívül szelektív kölcsönhatás lehetővé teszi, hogy egyetlen lépésben elérni egy nagyon magas fokú tisztítását a kívánt anyagot. Az affin kölcsönhatás nem kovalens, és enyhíthetők a pH változtatásával, ionerősség, oldat bevezetésére az anyagok, amelyek megakadályozzák a kialakulását komplementer kapcsolatok. Fontos előnye a affinitás kromatográfia: nagy szelektivitást, a hatás az anyag koncentrációja egy affinitás mátrixot és a kibocsátás a hidrolitikus enzimek. Affinitás-tisztítási gyakran megtartják a natív szerkezet veschestva.Chasche teljes ligandum kovalensen immobilizált mátrixot. A fix ligandum mátrixot kell előre aktivált, vagyis arra a felületre a hordozó részecskék kell létrehozni reaktív csoportokat. A leggyakoribb módszer az aktiválás - létrehozása a felszínen egy mátrixot elektrofil csoportok reagálni képes nukleofil csoportok a ligandum. A folyamat a immobilizáló ligandum csökkenti, hogy a lappangási az aktivált mátrixot. Meg kell jegyezni, hogy a reakció sebessége erősen függ a közeg pH-ja. Immunochemistry mátrixként használhatók immobilizálására antigén vagy antitest kapcsolódik a mátrix. Mozgás affinitáskromatográfia, amelyben, mint egy immobilizált ligandum ellenanyagot használjuk az úgynevezett immunaffinitás kromatográfiával.
Az egyik leggyakoribb média használt biokémiai az elmúlt néhány évtizedben a Sepharose - speciálisan kezelt gömb alakú gyöngyök agaróz. Számos módja van, hogy aktiválja Sepharose, de az aktiválás módszert alkalmazzuk gyakrabban, mint mások Sepharose cián-bromidot (BrCN). A módszer előnye az egyszerűség, a nagy ellenállást alakított kötvények stabil Sepharose egy meglehetősen széles pH-tartományban (2,0-12,0). A viszonylagos merevség és a nagy részecskeméretű Sepharose lehetővé teszik az ilyen közegek a kromatográfiás oszlopról viszonylag nagy előtolási sebességek a megoldások az oszlopban.
Aktiválása Sepharose inkubálást oldatban hajtjuk végre egy vizes szuszpenzióját brómcián Sepharose. Cianogén-bromidot reagáltatnak hidroxilcsoportjainak Sepharose alkotnak imidokarbonat tartalmazó elektrofil szénatom. Ezenkívül a reakció folyamán termel karbamát inaktív, nem képes a reakció nukleofil aminosav oldalláncokon. Reagáltatva nukleofil csoportokkal imidokarbonata elsősorban lizin e-amino-csoportok, a kialakulása az erős kovalens fehérje miatt a mátrix keresztül aktivált maradékot izokarbamid vagy N-szubsztituált karbamátot (ábra. 1). A reakciót cianogén-bromiddal végzett aktiválása a mátrix terjed csak lúgos közegben elválasztása hidrogén-bromiddal semlegesítéshez, amely megköveteli a folyamatos lúg hozzáadásával a reakcióelegyhez. A reakciót cianogén-bromid hidroxil mátrix exoterm, így végezzük jégfürdőben.
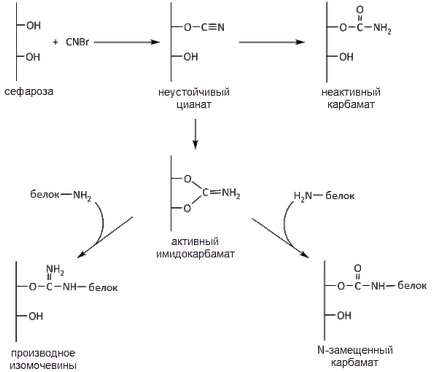
Ábra. 1. reakcióvázlat fehérje immobilizálása BrCN-aktivált szefaróz
Meg kell jegyezni, hogy az aktív nukleofilekkel mellett e-amino-lizin csoportjaival is SH-csoport, a cisztein és a terminális aminocsoport a protein-tirozin OH-csoport (a tevékenységre vonatkozó adatok csoportok vannak elhelyezve a következő sorrendben: SH ˃ terminális NH2 - ˃ OH-csoport, tirozin) . Másrészt, tioéterek kevésbé tartós, mint az oxigén-éterek és az utolsó rosszabb, mint az amid-kötés erőssége.
Az immunkémiai vizsgálatok alkalmazásával BrCN-aktivált szefaróz készített két típusú hordozók - hordozók immobilizált antigének és a média immobilizált antitestekkel. Az előbbi korlátozott használatra, és általában használt izolálásáról immun állati szérumot (amely különböző specificitású antitesteket) antitest medence külön csak a fehérje immobilizáltuk a hordozóra. Sokkal gyakrabban, hogy a gyakorlatban a fuvarozók rögzített antitestekkel. A fő alkalmazási Ilyen hordozók - extrakciójával durva keverékei makromolekulák (jellemzően - fehérjék). A nagy specifitást az antitest antigénhez lehetővé teszi egy rövid ideig, és egy lépésben, így nagy tisztaságú (tisztasága legfeljebb 95-99%) a fehérje hatóanyag.

Ábra. 2. Berendezés immunaffinitás kromatográfiás oszlopra
Az extrakciót a fehérje vizsgált végzik kétféleképpen az elegyből. Eredeti használt, rendszerint szerezni preparatív mennyiségű fehérjét, alapuló módszer immunaffinitás kromatográfiás oszlopra (2. ábra). Attól függően, hogy az affinitás hordozó feladatot töltött oszlopon különböző átmérőjű (egy néhány mm-től méter) és áthalad ezen oszlopok fehérje oldat tartalmazza az antigént vizsgált. A legtöbb makromolekuláris hordozó részecskék áthalad megállás nélkül, míg a rögzített antitestek a hordozó, és egy antigén tartalmazott egy olyan oldatban, amely immun komplex képződik (3.). Mosás után a támogatást a nem rokon fehérjék immun-komplexet áthaladó alacsony hordozó oldatban (pH = 2,0 - pH 4,0) vagy magas (pH 11,0 - pH 12,0) pH-értékek, vagy oldatok nagy ionerősségű (2 M NaCl), vagy oldatok, amely tartalmaz kaotropikus vegyületet (KSCN). Ebben az esetben a célfehérje eluáljuk a hordozóanyagban, akkor ennek az összegyűjtött és az optimális a fehérje tárolása pufferben.
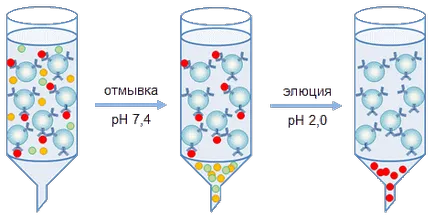
Ábra. 3. reakcióvázlat kromatográfia, a fehérjék egy affinitás közegben.
A második módszer a kitermelése a teszt protein egy komplex keverék - immunprecipitációval, vagy extrakcióval térfogata. Immunoprecipitáció használjuk, ha dolgozik a kis (nano- és mikrogramm) az anyag mennyisége a. A kötet a az affinitás hordozó jellemzően kevesebb, mint száz mikroliter, és térfogatát a vizsgálati minta - néhány milliliter. Ez azt jelenti, immun-helyzetekben használjuk, ahol miatt a kis mennyiségű anyag technikailag nehéz létrehozni egy megfelelő méretű affinitás oszlopon.
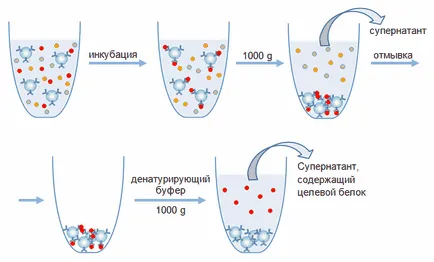
Ábra. 4. Az áramkör affinitása izolálnak fehérjéket immunprecipitációval.
Lefolytatása során az immunprecipitációs tartalmazó mintát a célfehérjét, inkubáljuk egy ideig (állandó keverés közben) a hordozó részecskék. Az inkubálás során az immun komplex képződik, és a célfehérje származó bevétel az oldatot a hordozó részecskék. Ezt követően, a hordozó kicsapjuk, jellemzően centrifugálással, a felülúszót eldobjuk, és az immunkomplex immobilizálva a hordozó részecskék hozzáadásával elbontjuk, valamint ugyanezen oldatok, mint abban az esetben, oszlopkromatográfiával (ábra. 4). Továbbá, az immunkomplex lehet semmisíteni SDS-t tartalmazó pufferben, amelyet előállítására A fehérje minta során SDS elektroforézis. Ezt a puffert használjuk az esetben, ha további vizsgálati tervet extrahált fehérjét módszerével elektroforézis denaturáló körülmények között, vagy a Western-blottal. Azonban, ha ezt a módszert, a fehérje elúciós kell jegyezni, hogy hordozó újrafelhasználás lehetetlenné válik, mivel a denaturálódását az immobilizált antitestekkel. Ezen túlmenően, a minta amellett, hogy a célfehérje tartalmaz a könnyű és nehéz láncokat az immunglobulinok.