Módszerek tanulmányozása termodinamikai folyamatok

Home | Rólunk | visszacsatolás
A tanulmány valamennyi folyamatot tekintik egyenrangú tavasszal és visszafordítható.
Mielőtt rátérnénk az eljárás a tanulmány a termo-dinamikus folyamatok, bemutatjuk az ötödik paraméter állásától a gáz - entrópia S. entrópia jellemzi az áramlás irányában a hőcserélő között a rendszer és a külső környezet.
Egy tetszőleges gáztömeg G (kg) s entrópia mért kJ / K, és 1 kg gáz entrópia betűvel jelöljük S és mértékegysége kJ / (kg • K), azaz ugyanabban az egységben, mint a tömeg hőkapacitás.
A termodinamika, az entrópia változása határozza csak # 916; S = S - S. Ebben a tekintetben, hagyományosan úgy vélte, hogy 0 ° C-on, és bármilyen nyomáson entrópia S, valamint a belső energia, és egyenlő nullával.
Segítsége nélkül magasabb matematika, a pro-freestyle (politrop) termodinamikai folyamat felírható:
ahol # 916; Q - mennyiségű hő vesz részt olyan elemi termodinamikai folyamat, kJ / kg;
# 916; S - entrópia változása ezt az elemi folyamat, kJ / (kg # 8729; K).
hozzáállás # 916; q / T nevezzük a redukált hő és jelentése minőségi jellemzője az átalakítási folyamat hő.
A változás entrópia függvényében állam nem függ a folyamat áramlási útvonalat (azaz, az átmenet munkafolyadék), és a kezdeti és a végső állapot,
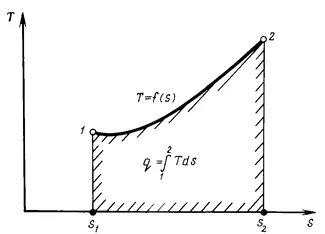
Bemutatjuk az entrópia fogalmának a paraméterként az állami Rabo amely test lehetővé teszi, hogy alkalmazni kell tanulni termodinamikai-idézésben feldolgozza az új (pv-diagram korábban bevezetett) közvetlenül a szén-T koordináta-rendszer, s, ahol az abszcissza a megfelelő méretű feküdt s entrópia, és a tengelyirányú ordináta - abszolút hőmérséklet T. Ez a táblázat az úgynevezett JELÖLI-Ts-diagram (1.6 ábra.).
Ezen az ábrán, a határolt területen per - set, csökkentette az abszcisszán a pontok a kezdeti és a végső állapotok, és az abszcissza fejezi száma jelentett vagy visszavonása hő q. Ezért Ts-diagramot is nevezik termikus vagy entrópia. Mint a egyenlet (1,54), a T hőmérséklet - érték mindig pozitív-TION, a # 916; s és # 916; q ugyanaz az előjele, azaz q Ha hőt, hogy a gáz (pozitív érték), majd a # 916; S növekszik. Ezzel szemben, ha a # 916; Q adott (negatív érték), majd a # 916; S csökken. Ez az egyik legfontosabb tulajdonsága az entrópia.
definiált-lyayut a tanulmány a termodinamikai folyamatok:
1) Az eljárás egyenlet és grafikus kép a koordináta-rendszerben p, v,
2) közötti kapcsolat a fő paraméterei állapotában a gáz;
3) változás belső energiája a gáz # 916; u, és a munka értékét a terjeszkedés l;
4) A hőmennyiség q, átadódik a gáz vagy vonni a forgalomból;
5) Az eljárás képet a koordináta-rendszerben a T, s.
Process előforduló állandó térfogaton hívják izochor. Izochor folyamat különösen érvényes kiszámítása során az elméleti ciklus MOTOR teley karburátor a belső égésű motor (ICE). folyamat egyenlete
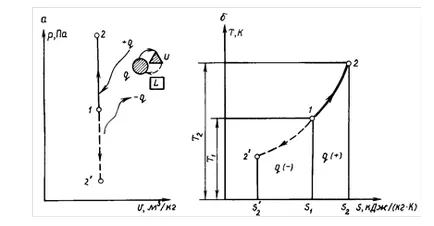
A pv-anagramma (ábra. 1.7) a folyamat gráf egy egyenes vonal merőleges az abszcissza és a hívott isochore.
Állandó térfogaton # 916; # 965; = 0 a megfelelő terület # 961; # 965; -diagram a tágulási l. Azt is nulla. Következésképpen, a izochor állapotváltozás gázt az expanziós munka L = 0.
A kapcsolat a gáz változó paramétereket a következő egyenletből meghatározzuk (1,13), rögzítve a kezdeti és a végső L 2 (lásd a 1.7 ábra, a ..) Államok:
Elosztjuk az Terminusonként megkapjuk
Egyenlet (1,56) azt mutatja, hogy a izochor állapotváltozás gáznyomás egyenesen arányos az abszolút tempera-körben.
Mivel a folyamat l = 0, akkor egyenlet szerint (1,48) a munkaközeg szállított hő q teljesen elfogy a változás a belső energia:
A folyamat 1-2 „(lásd. Ábra. 1.7, a) Q hőt eltávolítjuk a gázból, ezáltal csökkentve annak hőmérsékletét. Következésképpen-eljárás 1 - 2 „- lehűtjük a munkaközeg (- q).
Változás a konkrét entrópia # 916; S = S - S. a izochor állapotváltozás (hőkapacitása állandó C) megszámoltuk, amelyet a képlet
ahol # 916; S - entrópia változása a gáz, kJ / (kg • K); C - az átlagos hőkapacitása a gáz tömegének a folyamatot, amikor v = idem; T. T; az a hőmérséklet, az elején és végén a folyamat, K.
Egyenlet (1,59) azt mutatja, hogy a izochor folyamat képviseli a koordináták T, S logaritmikus görbe (lásd 1.7 ábra, b ..), és folyik, így, hogy a hőbevitel (+ q) növeli entrópia és a gáz hőmérséklete, és a hőelvezető (- q), ezt a paramétert csökken.
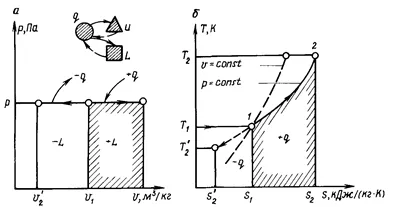
Eljárás folyik, állandó nyomású úgynevezett izobár. Egy ilyen eljárás mutathatnak termodinamikai-tech a hengerben, a dugattyú, melynek mozgatjuk súrlódás nélkül, úgy, hogy a nyomás a hengerben állandó, és egyenlő a nyomás a környezet dugattyút.
A pv-diagram (. 1.8 ábra) izobár egy egyenes vonal párhuzamos az x-tengely (a tengely a fajlagos térfogat v):
1 - 2 - hővel ellátási (+ q), és 1 - 2 „- hőelvételi
A kapcsolat az értékek a főbb változók
paraméterei a munkafolyadék állapotot határozzuk meg a Clapeyron egyenlet (1,13), rögzítve az 1. és 2. pont:
Így növelésével a fajlagos térfogata a gáz a izobár folyamatban, annak hőmérséklete emelkedik, a készség-shenii - csökken.
gáz az expanziós munka l (.. lásd 1.8 ábra, a) által képviselt vonala alatti terület a folyamat 1 - 2 - expanziós (+ l), és a vonal 1 - 2 „- kompressziós (- l). Ábra. 1,8, és az is világos, hogy a munka expanzió lehet meghatározni az egyenlet
Ha a gáz mennyiségét, hogy kijelölje a G (kg), a képlet a munkát a tágulási válik L
Miután általános képletben (1,63) a különbség az abszolút hőmérséklet, T - T = 1 K, azt kapjuk, hogy L = R. Ez lehetővé teszi, hogy meghatározzuk a fizikai értelmében a specifikus gázállandó mint a munka bővítése 1 kg ideális gáz, amikor melegítjük 1 K p = idem.
A változás a belső energia az ideális gáz egy jól ismert-CIÓ hőmérséklet értékeket az elején (T), és a végén (T) PROTSES-ca (feltételezve állandó specifikus hő C) fejezzük egyenlet-niem
A hőmennyiség által közölt a munkaközeg a folyamat határozza meg a matematikai kifejezést termodinamikailag első törvény (1,48) a egyenletek (1,63) és a (1,65):
a képlet szerint (1,30) C = + R.
Változás az adott entrópia az izobár alatt olvasható a következő egyenlet
Következésképpen, Ts-diagram izobár folyamat, valamint a izochor ábrázolt logaritmikus görbe, de sekély képest isochore (lásd. Ábra. 1.8, b). Ilyen relatív helyét izobár és isochore a TS- diagram annak a ténynek köszönhető, hogy a fajhő C>.
A hőmennyiség q grafikusan ábrázolja folyamat Xia területen (lásd 1.8 ábra, b ..) által definiált görbe eljárással (január 01-02 - 2 „), és az abszcissza tengely.
A kapcsolódó folyamatok kiszámítása Kazánházak, gőzturbinák, valamint a szárítási és hűtési-vidéki gazdasági termelés használt paraméter munkaközeg állapotban (gáz), az úgynevezett entalpia - teplosoderzha-niem. Fajlagos entalpia jelöljük H és mérjük kJ / kg. A bevezetése a „entalpia” amellett, hogy a korábban tárgyalt (nyomás, fajlagos térfogat, tempera-túra, belső energia, entrópia) p, V, T, U, s elősegíti a tanulmány a folyamatok hőerőgépek, különösen gőzturbinák.
Ez a beállítás az állapot
Ha a (1,68) és a helyettesítő pv és azok értékeit, és nevezetesen a T = C, és PV = RT, megkapjuk
Ezért a entalpiája ideális gáz számszerűen egyenlő a termék a fajhő tömegállandóságig-megakadályozására osztást az abszolút hőmérséklet. A „entalpia” adhat a következő magyarázatot. Tegyük fel, hogy a hengerben, a dugattyú alá 1 kg gáz. Tedd a dugattyú felső terhelési tömeg G, egy kiegyensúlyozó gáz nyomás p.
ahol F - területe a dugattyú.
Az egész rendszer egyensúlyban van. Ebben az esetben az energia a rendszer (1 kg gáz és a terhelés) egyenlő a belső energia és a gáz, valamint a potenciális energia tömegű G, emelt magasságban H, egyenlő a magassága a henger:
Mivel a FH = U (azaz 1 kg gáz térfogata a hengerben), a teljes energia a rendszer, és egyenlő + PV = H - legnagyobb entalpiáját.
A Thermal számítás általában szükséges, hogy ismerjük a változás entalpia
(# 916; h = h - h), nem pedig annak abszolút értéke. Ezért a származási
(0 K vagy 0 ° C-on) a végeredmény (# 916; h) nem számít.
Egyenletet használva (1,48) könnyen azt mutatják, hogy bármely gáz a folyamat állandó nyomáson (izobár, p = idem) hőbevitel megegyezik a entalpiakülönbség végén és elején a folyamat:
szerint vagy az (1,68)
Következésképpen, a izobár összegzett hőmennyiség-sósav különbség határozza meg a entalpiája a végén (h) és a start (h) a folyamat.