Oia kémiai egyensúly
Állami vegyszer. egyensúlyi - olyan állapot, amelyben a kiindulási termékek és him.potentsial in-egyenlő, figyelembe véve a sztöchiometriája a folyamat.
A kémiai egyensúly tud beszélni két feltétellel:
Speed előre és hátra reakciók egyenlő.
Egyensúly áll fenn, ha a külső nyomás, akkor, amikor eltávolítjuk a rendszer visszatér, hogy a kezdeti állapot.
11.Zakon tömeghatás.
Állandó hőmérsékleten, a kémiai reakció sebessége egyenesen arányos a termék a reagáló anyagok koncentrációit, hozott fok, egyenlő a sztöchiometriai együtthatók az egyenletben a reakció.
Például, az ammónia szintézis reakció:
tömeghatás törvénye a következő:
12.Konstanta egyensúlyi homogén rendszerben. Módjai kifejezés az egyensúlyi állandó.
egyensúlyi állandó - egy állandó arány egyenlő a egyensúlyi koncentrációinak a végtermékek és kiindulási a reagensek, egyesítjük egy mértékben megfelel a sztöchiometrikus együtthatók
Homogénnek nevezzük reakciókat egyetlen fázis: gázok keveréke folyékony vagy szilárd oldatban néha.
Módon kifejező egyensúlyi állandó
Ha a koncentrációt az anyagok vesz részt a reakcióban, kifejezett moláris egységekben molaritásban. azaz mol / l, ez általában a továbbiakban Kc
A homogén gáz reakció egyensúlyi állandó kényelmesebben kifejezve parciális nyomásának anyagok:
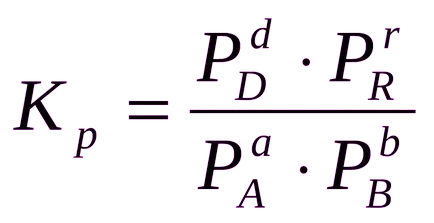
Néha kényelmes, hogy kifejezzék a egyensúlyi állandó nem szempontjából parciális nyomás és koncentráció, és számos anyag:
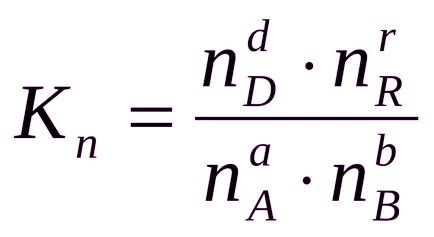
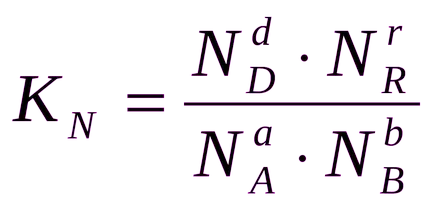
Általában az egyensúlyi állandó Ks, Kp, és Kn különböző RN.
ha a rendszer egyensúlyban van, akkor egy külső fellépés, az egyensúly eltolódik abba az irányba, amely csökkenti a külső hatás.
14.Uravnenie isobar van't Hoff.
Ez a kifejezés minőségileg hatását értékelni T a mérleg és az egyensúlyi állandó.
Fázis nevezett - homogén részében heterogén rendszer, amelynek egy igazi felület, amelyen belül az összes tulajdonságait változhat folyamatosan, de az átmenet során, amelyen keresztül egy ugrás.
16.Sostavlyayuschie anyagok és alkatrészek.
Component nevezik - a minimális számú alkatrészre az in-elégségesnek bizonyult az állami rendszereket.
Veschestvaminazyvayutsya alkatrészek - anyagok teszik ki a rendszer, amely lehet kinyerését hagyományos preparatív technikákkal, és amely létezhet a rendszeren kívül a végtelenségig.
A szabadsági fok a termodinamikai egyensúly a rendszer, amelyről csak a külső befolyásoló tényezők a hőmérséklet és a nyomás, a több független komponensek egyenlő C = R-F + n (a száma külső paraméterek)
fázisú szabály azt mutatja, hogy a szám a szabadsági fokok számával növekszik az alkatrészek és csökken a növekvő fázisok száma a rendszer.
18.Usloviya fázisegyensúly a rendszerben.
A heterogén rendszer egy fázis egyensúlyi, ha a következő típusú egyensúlyok fázisok között:
Thermal (egyenlőség hőmérséklet)
Mechanikus (egyenlő nyomás)
Kémiai minden komponens
ahol, -ΔV- térfogatváltozás anyag annak átmenet az első szakasz a második T - átmeneti hőmérséklet, AH - a változás entrópia és entalpia az anyag az átmenet 1 mól egy anyag az egyik fázisból a másikba
Ez lehetővé teszi, hogy értékeljék a hőmérséklet vagy nyomás alatt a fázisátmenet, ha változik a paraméter 2.
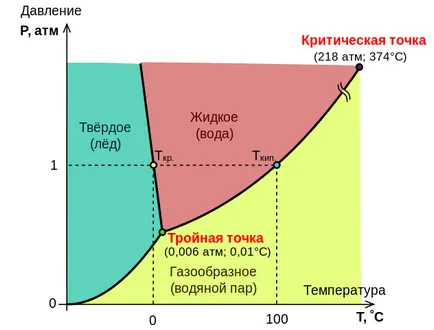
20. A állapotdiagram víz
A kapcsolatban közötti mennyiségek jellemző a rendszer állapotát, és fázis változások a rendszer átmenet a szilárd anyag folyékony, a folyadék gáz halmazállapotú
21.Istinnye megoldásokat. Módszerek expresszálására koncentráció oldatot. Kiszámítása a móltömeg és a moláris aránya az anyag és az anyag koncentrációja az oldatban.
A valódi oldat - egyfajta megoldást, ahol az oldott részecskék mérete rendkívül kicsi, és hasonló a részecskemérete az oldószert.
Az oldatok gáz (gázkeverék) folyadék itverdye. Gáznemű megoldás levegőt. Tengervíz - sók keveréke vízben - folyékony oldatban. A szilárd oldatok - fémötvözetek. A megoldások állnak az oldószer és az oldott anyag (ok).
Megoldás úgynevezett szilárd vagy folyékony, homogén rendszer, amely két vagy több komponens.
Az oldószert tartják - a meghatározása a fizikai állapotát az oldat vagy az, amely nagyobb, térfogat vagy tömeg.
Koncentrálási eljárásokkal oldatok expresszió.
oldat koncentrációja - a tömeg vagy a számát az oldott anyag egy adott mennyisége, súlya vagy térfogatú oldatot vagy oldószert.
1) Tömeg frakció (wi) - az oldott anyag tömege tartalmazott 100 g oldatot.
3) A molal koncentráció (molalitás) Mi - móljainak száma az oldott anyag tartalmazott 1 kg oldószer [mol / kg].