Osztályozása kémiai reakciók a szerves és szervetlen kémia, EGE a Chemistry
Osztályozása kémiai reakciók a szerves és szervetlen kémia
A kémiai reakciók vagy kémiai jelenségek - a folyamatok eredményeként, amely néhány más anyagok keletkeznek, amelyek különböznek az őket szerkezetét és (vagy) szerkezet.
Amikor a kémiai reakciók szükséges változást az anyagok, amelyekben a könny régi és az új kötések alakulnak atomok között.
A kémiai reakciók meg kell különböztetni a nukleáris reakciókat. Ennek eredményeként a kémiai reakció, az atomok számának összege minden egyes kémiai elem és izotóp-összetétel nem változik. Egy másik anyag a nukleáris reakció - átalakulási folyamatok az atommagok, mint eredményeként a kölcsönhatás más magok, vagy elemi részecskék, például magnézium-alumínium-konverzió:
Sokoldalú osztályozása kémiai reakciók, azaz a Különböző funkciókat lehet tenni annak alapján. Azonban, semmilyen ilyen funkcióinak sorolható a reakció között szervetlen és szerves anyagok közötti.
Tekintsük a besorolás kémiai reakciók különböző okokból.
Osztályozása kémiai reakciók számát és a reagensek összetételétől. Reakciók megy megváltoztatása nélkül az anyag összetételének
A szervetlen kémiában az ilyen reakciók közé tartozik például a feldolgozási eljárások allotropic módosításai kémiai elem, például:
A szerves kémiában az ilyen típusú reakció említett izomerizációs reakciók, hogy menjen megváltoztatása nélkül nemcsak minőségi, hanem mennyiségi összetétele molekuláris anyagok, például:
1. izomerizálása alkánok.
Izomerizâlása alkánok nagy gyakorlati jelentősége van, mivel elágazó láncú szénhidrogének kevésbé képesek robbanásba.
2. izomerizációja alkének.
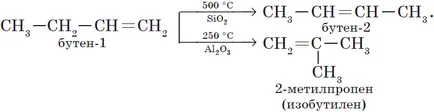
3. Az izomerizálást alkinek (A. E. Favorskogo reakció).
4. Az izomerizálást halogén-alkánok (A. E. Favorsky).
5. Az izomerizálást ammónium-cianát melegítés.
Először karbamidot állítottunk elő F. Wohler 1882 izomerizációs ammónium-cianát hevítve.
A reakciók mennek végbe a változás az anyagösszetétel
Négyféle Ezen reakciók lehet megkülönböztetni: a vegyület bomlás, szubsztitúciós és cseréjét.
1. reakciói vegyület - azok reakciókban, amelyekben két vagy több anyagból kialakítva egy összetett anyag.
A szervetlen kémia reakciók összes vegyület sokrétű lehet vizsgálni a példa szerinti reakciók kénsav előállítására kén:
1) létrehozunk egy kén-oxid (IV):
$ S + O_2 = SO_2 $ - két egyszerű keletkező anyagok egy komplex;
2) kéntartalom-oxid (VI):
$ 2SO_2 + O_2↖2SO_3 $ - egyszerű és komplex vegyületek által képzett egyetlen komplex;
3) kénsav előállítására:
$ SO_3 + H_2O = H_2SO_4 $ - a két kompozit anyagok kialakítva egy komplex.
Egy példa a reakció vegyület, ahol egy komplex vegyület képződik több, mint két forrásból szolgálhat az utolsó lépés megszerzésének salétromsav:
A szerves kémia, a reakció vegyületet általában úgynevezett addíciós reakcióval. Minden sor ilyen reakciók lehet tekinteni egy példa a blokk reakciók jellemző tulajdonságai a telítetlen vegyületek, mint például az etilén:
1) hidrogénezési reakciót - hozzáadásával hidrogén:
2) a hidratálási reakciót - víz hozzáadásával:
3) egy polimerizációs reakció:
2. A bomlástermékek reakciók - ezeket a reakciókat, amelyek egy komplex anyag a kialakult számos új anyagot.
A szervetlen kémia egész sokféle ilyen reakciók lehet tekinteni például blokkolja a termelés oxigén reakciók laboratóriumi módszerek:
1) bomlása higany-oxid (II):
$ 2HgO↖2Hg + O_2 ↑ $ - az egyik vegyület képződik két egyszerű;
2) bomlása a kálium-nitrát:
$ 2KNO_3↖2KNO_2 + O_2 ↑ $ - az egyik vegyület képződik egy egyszerű és egy komplex;
3) bomlása kálium-permanganát:
$ 2KMnO_4↖K_2MnO_4 + MnO_2 + O_2 ↑ $ - egy komplex anyag képződött két komplex és egyszerű, azaz Három új anyagok.
A szerves kémia, a bomlási reakció lehet tekinteni például etilén tömb megszerzése reakciókat a laboratóriumban és ipari:
1) a reakció dehidratációs (víz eliminálása) etanol:
2) reakciója dehidrogénezési (hidrogén absztrakció) -etán:
3) krakkolási reakció (hasítás) propán:
3. szubsztitúciós reakciók - ezek a reakciók, mint amelynek eredményeként egy egyszerű anyagot tartalmazó szubsztituált alkilcsoport bármely elemének egy komplex közegben.
A Inorganic Chemistry, példák az ilyen folyamatok szolgálhat reakciók blokkolására jellemző tulajdonságaik, például fémek:
1) a kapott alkálifém- és alkáliföldfém vízzel:
2) a kapott fém-savas oldatban:
3) a kapott fémsókkal az oldatban:
A tanulmány tárgyát szerves kémia nem egy egyszerű dolog, és az egyetlen kapcsolatot. Ezért, mint egy példa a szubsztitúciós reakciók bemutatni a legjellemzőbb tulajdonsága korlátozó vegyületek, különösen a metán, - a képessége annak hidrogénatom halogénatom helyettesít:
Egy másik példa - az brómozásával aromás vegyületek (benzol, toluol, anilin):
Megjegyzés: a funkció szubsztitúciós reakciókat szerves anyagok, mint eredményeként az ilyen reakciókkal egy komplex, és nem egy egyszerű dolog, mint a szervetlen kémiában, és két összetett anyag.
A szerves kémiában szubsztitúciós reakciók közé tartozik néhány közötti reakció két összetett anyagok, például nitrálással benzol:
Ez hivatalosan csere reakciót. Hogy ez szubsztitúciós reakció, világossá válik, csak akkor, ha figyelembe véve a mechanizmus.
4. kicserélődési reakciók - ezeket a reakció, amelynek során két észter ágens alkotórészeire.
Ezeket a reakciókat az jellemzi, tulajdonságai elektrolitok megoldások átfolyó Berthollet szabály, azaz a Csak akkor, ha csapadék képződik eredményeként, gáz vagy malodissotsiiruyuschee anyag (például $ $ N_2O).
A Inorganic Chemistry, lehet, hogy egy blokk a reakciók jellemző, például lúgokkal tulajdonságok:
1) a reakcióelegyet semlegesítjük fogja alkotni só és víz:
vagy ionos formában:
2) közötti reakciót alkáli-és só, ami megy, hogy létrehozzák a gáz:
vagy ionos formában:
3) közötti reakciót az alkálifém-sót és a gyalogos csapadék képződése:
vagy ionos formában:
A szerves kémia reakciókat úgy blokk jellemző, például ecetsav tulajdonságok:
1) reakciót, ami megy alkotnak egy gyenge elektrolit - $ H_2O $:
2) reakció gáz fogja alkotni:
3) reakció megy csapadék képzése:
Osztályozás a kémiai reakciók, hogy módosítsa a oxidációs állapotban kémiai elemek képző anyag
A reakciókat, amelyek a változás elemeket oxidációs állapotok, vagy a redox reakciók.
Ezek közé tartoznak a különböző reakciók, beleértve az összes szubsztitúciós reakciókat és e reakciók és a vegyület elbomlását, amely az érintett legalább egy egyszerű anyagot, mint például:
Ahogy emlékszem, az összetett redox reakciók elő elektron egyenleg módszer:
A szerves kémia példája redox reakciók aldehidek szolgálhat tulajdonságok:
Aldehidek 1 visszaáll a megfelelő alkoholok:
2. aldehidek van oxidálva a megfelelő savak:
Reakciók séta megváltoztatása nélkül oxidációs fokú a kémiai elemek.
Ezek közé tartozik, például, közé tartozik az összes ioncserélő reakció, valamint a:
- Sok kapcsolási reakció:
- Sok a bomlási reakció:
Osztályozás a kémiai reakciók a termikus hatása
A reakcióhőt osztva az exoterm és endoterm.
Ezeket a reakciókat az energia felszabadulással jár.
Ezek közé tartozik szinte az összes kapcsolási reakciót. A ritka kivétel endoterm reakciók nitrogén-monoxid szintézis (II) a nitrogén és oxigén, és a reakciót a hidrogén-gáz szilárd jódot:
$ N_2 + O_2 = 2NO - Q $,
Exoterm reakció előforduló felszabadulása a fény, a továbbiakban égési reakciók, például:
A hidrogénezést etilén - Példa exoterm reakció:
Ez szobahőmérsékleten.
endoterm reakció
Ezek a reakciók az energia felszívódását.
Nyilvánvaló, hogy azok tartalmazzák szinte az összes bomlási reakciót, mint például:
a) pörkölés mészkő:
b) repedés bután:
Száma izolálhatjuk vagy abszorbeált eredményeként a reakció energiát nevezzük a reakcióhőt. egy kémiai reakció egyenlete jelezve ezt a hatást nevezik termokémiai egyenlet. például:
Osztályozása kémiai reakciók az aggregált állapotban a reaktánsok (fázis összetétele)
Ez a reakció, amelyben a reaktánsok és a reakciótermékek a különböző aggregációs állapotokat (különböző fázisok):
Ez a reakció, amelyben a reaktánsok és a reakciótermékek állapotban vannak aggregációs (egy fázis):
Osztályozás a kémiai reakciók a katalizátor részvétel
Nem-katalitikus reakciók járjon katalizátor nélkül részvétele:
Katalitikus reakciók fordulnak elő a katalizátorral:
Mivel minden biológiai reakciókat, amelyek a sejtek az élő szervezetek, amelyek jellemző speciális biológiai katalizátorok protein jellegűek - enzimek, mindannyian tartozik a katalitikus vagy, pontosabban egy enzimatikus.
Meg kell jegyezni, hogy több mint 70 $ $% kémiai produkció katalizátorok alkalmazásával.
Osztályozása kémiai reakciók irányába
Irreverzibilis a reakciók ilyen körülmények között csak az AP irányba.
Ezek közé tartozik az összes kicserélődési reakció, képződése kíséri iszap, gáz vagy malodissotsiiruyuschego anyag (víz), és az összes égési reakció.
Váltvaforgató reakciók ilyen körülmények között történhet egyidejűleg két ellentétes irányban.
Ezek a reakciók túlnyomó többségét.
A szerves kémia, a jele a reverzibilitás tükrözik név-antonimák folyamatok:
- gedrirovanie - dehidrogénezés;
- Hidratálás - kiszáradás;
- polimerizáció - depolimerizáció.
Minden reverzibilis észterezési reakció (az ellentétes folyamat, mint tudjuk, az úgynevezett hidrolízis) és a fehérje hidrolízis, észterek, szénhidrátok, polinukleotidok. Reverzibilitás megalapozza a legfontosabb folyamat az élő szervezetben - anyagcserét.