Ribozimek a gyógyszerek
Az eredmények alapján élményt, valamint más tudást halmozott fel a kialakult ribozimek véleményét a lehetőségét, hogy a ribozimok aktivitásának szabályozására bizonyos emberi génekkel. Scope ribozimokból mivel a gyógyszerek is nagyon széles. A lehetséges felhasználási területek a klinikákon jelenleg mérlegeli a vírusos fertőzések kezelésére, rák, mely termékeket az onkogének ismertek, valamint a patológiás állapotok által okozott túlexpresszálása specifikus gének.
Egy másik megközelítés, hogy leküzdésére a HIV-fertőzés a hasítását a 5'-terminális süveg szerkezet HIV RNS ribozimok. Ismeretes, hogy a legtöbb HIV-izolátumok 5'-terminális vezetőszekvencia a genomiális RNS-t nagymértékben konzervált. Az összes ismert izolátumai törzs MN tartalmaz csak egy nukleotid szubsztitúció, a leader régióban RNS hasítható ribozim. Ugyanakkor vizsgáltuk HIV-törzseket eltérő más részeinek az 5'-terminális vezetőszekvencia. Endonukleáz eltávolítása részeként az oligonukleotid 5'-terminális blokkoló csoport a HIV RNS elnyomja fordítását RNS és teszi hozzáférhetővé a megcélzott intracelluláris nukleázok. Az összes rendelkezésre álló kísérleti adatok lehetővé teszik számunkra, hogy a mai következtetést a kilátások használatát az 5 „végén a vezető szekvenciája HIV RNS célként ribozimok.
A fő nehézség, hogy le kell küzdeni a tervezés ribozimokból hasító genom HIV RNS a nagy változékonysága az RNS. Mivel a egyedüli nukleotid-szubsztitúcióban mutáció helyén, ami hasítja az RNS ribozim, az utóbbi elveszítik aktivitásukat tekintetében ezen RNS-ek, és ennek megfelelően vírusellenes aktivitást. A legújabb stratégia a probléma kezelése létrehozni több ribozimok ellen irányul különböző konzervált régiók a HIV-genom, az egyes ribozimok kell vonni egy molekula a rekombináns RNS-t ( „shotgun szekvenálási”). Amellett, hogy antivirális ribozim szekvenciák, mint a rekombináns RNS tartalmaz cisz -action további ribozimok, hogy hajtsa végre a feldolgozást autokatalitikus ribozim vírusellenes prekurzorok a kiadás érett ribozimek ható különböző részeit a virális genom. Ez a módszer nem teszi lehetővé a HIV-vírus, hogy elkerüljék inaktiváló akció ribozimokból mutációs változások genomjában.

Ábra. II.26. Restrikciós helyek alkalmazásával az építési ribozim, antiszensz RNS integrálódik
Nemrégiben kazettát kapunk kilenc azonos ribozim gén elrendezve egymás mögött az azonos expressziós vektorba. A ribozimok egy ilyen „policisztronos” RNS ellen irányuló különböző részein a HIV genom, fennmaradjon a specificitása sejtek, de hatékonyabb volt a szempontjából egyetlen példányát az RNS poliribozima és nem veszíti el tevékenységét, még részlegesen degradált RNS-molekulák.
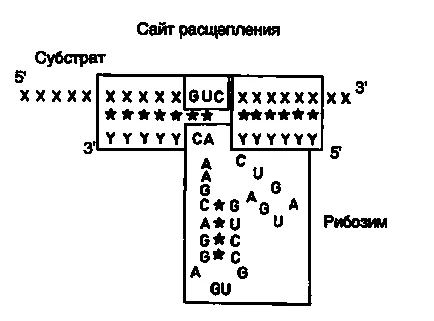
Ábra. II.27. Kölcsönhatás ribozim RNS-szubsztrát
Arra a következtetésre jutott ebben a szakaszban, esetleg egy példa a ribozimok alkalmazásával a növényi vírusok a mezőgazdaságban. Amint a fentiekben említettük, ribozimok, amely egy típusú „kalapácsfej” szerkezet felismeri a hasítási hely a cél-RNS-szekvencia a három nukleotid szomszédos hidrolízis RNS-szálat bekövetkezik. Hasonló trinukleotid szekvenciák lehetnek AUC, CUA, CUC, GUA, GUC, GUU és UUC. A javasolt megközelítés esetén a RNS-kötő doménjét a ribozim van kialakítva oly módon, hogy egy felismerhető részét trinukleotid nukleotidok szekvenciáját kettős szálú DNS-t, hogy képez egy restrikciós helyet. Ez a megközelítés lehetővé teszi, hogy bele ribozim katalitikus domén szekvenciája restrikciós helyet tartalmazott a cDNS reverz transzkripciójával kaptunk, A cél-RNS. Következésképpen, a katalitikus domén a ribozim szegélyezik szekvenciák antiszensz RNS komplementer a cél-RNS, amely automatikusan elvégzi a szerepe RNS-kötő domén. Ebben a megközelítésben nincs szükség a szintézis nagyszámú oligonukleotid, és minden esetben szükséges ribozimgénnek össze előregyártott blokkok. Mint egy konkrét példaként, úgy az építkezés egy rekombináns ribozim specifikusan hasítja az RNS szekvenciát tartalmazó restrikciós helyét Sall (ábra. II.26). Hasítása után cDNS-t Sall restrikciós enzim (1. lépés) az így kapott „ragadós” végződik hidrolizált S1 nukleáz (2. lépés) és a képződött „tompa” végek behelyezett ribozim katalitikus domént zárt kettős szálú DNS-fragmentumot (3. lépés). Ennek eredményeként ez a kialakítás szintetizáljuk átírására antiszensz RNS, amely tartalmazza az összetétel a katalitikus domén a ribozim. A hibridizáció után a cél-RNS-formák kettős szálú RNS-molekulát, amelyek közül az egyik van kialakítva láncok típusú ribozim szerkezet „kalapácsfej” (ábra. II.27), lehasítjuk a megcélzott RNS-t egy specifikus helyen. A leírt megközelítést hajtott végre a tervezés egy ribozim ellen irányul az RNS-genom vírusok szilva. Így kaptuk a ribozim szekvenciája nukleotid alkalmas a másik 25 restrikciós helyek.
Elnyomása onkogén funkció. Az egyik fő különbség kimutatható a normális és a rákos sejtek genetikai különbségek számos szabályozó gének szaporodását. A genom a tumorsejtek gyakran mutatnak gének mutációi két típusa: onkogének és tumorszuppresszor gének a növekedés, vagy anti-onkogének. Onkogének evolúciósan konzervált és indukálják sejtek neoplasztikus átalakulásait mind retrovírus-fertőzés természetes körülmények között (mivel gyakran építeni a retrovirális genom), és miután DNS bevezetését onkogén tenyésztett sejtekbe transzfekcióval. A legtöbb onkogének eredetileg kimutatható az összetétele a genom onkogén vírusokból származó, és ezek mutáns származékai proto-onkogének, amelyek jelen vannak az egészséges sejtekben a többsejtű organizmusok, és aktiválódnak az embriogenezis alatt, a sejtek növekedését és a szövetek regenerálódását. Mivel aktivált onkogének a tumorsejtekben, általában overexpresszált és RNS által kódolt okán elsődleges szerkezet eltér az RNS protoonkogének, onkogének RNS egy jó potenciális célpontja ribozimok.
Oncogene H-ras. A mutáció kodon 12 H-ras gén. vezető GGCGUC csere létre konszenzus hely, amelyen a HH-ribozim képes hasítani a mutáns mRNS-t. In vitro mutattuk ki egy öt-szeres különbség van a hatékonyságát a ribozim a mutáns H-ras-RNS-t és a megfelelő vad típusú RNS-t. Kapunk H-ras -függő sejtvonalat stabilan transzformáljuk egy expressziós vektorba, amely a szintézisét HH-ribozim szabályozása alatt egy promoter -aktin gén. Ezen sejtek csökkent proliferáció mértéke jellemző, párosulva a csökkenése intracelluláris szintjét a H-ras-RNS, és a p21-protein ezen gén által kódolt. További ribozim expresszálódik a sejtvonalban EJ humán húgyhólyag-karcinóma. A bevezetése őssejtek egerekben kísérte a gyors halál a háttérben a rendkívül invazív tumorok. Ezzel szemben, klónok EJ-expresszáló sejtek ribozim a szervezetben az egerek már drasztikusan csökkentette a tumor fenotípus. Ezeket a tumorokat minimálisan invazív, és megfigyelhető volt, körülbelül két-szeres növekedés a túlélési egerek átültetett. A szövettani vizsgálatok megerősítették a gyenge képességét daganatok áttétet. A ribozimok daganatokat detektáltunk PCR-rel 86-90 napig. Így, ezek és más kísérletek kimutatták a képességét, ribozimek, hogy normalizálják a expresszióját aktivált H-ras mind in vitro, és in vivo.
Onkogenc-fos. Amint az I. rész, protein gén termék c-fos részt vesz az átviteli jel eukarióta sejtek, részt vesz a DNS-szintézis, és tudják fejteni sejtek rezisztenciát rákellenes gyógyszerek. Ez utóbbi két tulajdonság e protein megerősítik, különösen az a tény, hogy a kezelés alatt a leggyakrabban alkalmazott rákellenes hatóanyag ciszplatin (cisz-diamminedichloroplatinum) fordul elő gén c-fos indukciós után dTMP-szintáz gének és DNS-polimeráz. A ribozim, hogy megbontja a c-fos mRNS csökkenti gén expressziós szintjét a végső c-fos. eredményezett fokozott érzékenysége a tumorsejtek kemoterápiás szerekkel (beleértve a cisz-platina), és szignifikánsan gátolta a gének expresszióját dTMP-szintáz DNS-polimeráz és humán metallotionein-gént hMTII-A.
Onkogén bcr / abl. Aberráns Philadelphia-kromoszóma transzlokációja alakítja ki (9; 22) (q34; q11) a csontvelőben őssejtek, amely kíséri gén fúziós bcr és abl onkogént alkotnak egy kiméra bcr / abl és a krónikus mieloid leukémia (CML). Az átirat egy kiméra gén egy olyan fehérjét kódol p210 bcr / abl. amely fokozta tirozin kináz aktivitását. Az ilyen RNS-t és fehérjét találtak majdnem minden betegnél egy szindrómája CML, valamint 50% a betegek akut limfoblasztoid leukémia, akik egy Philadelphia kromoszóma. A ribozim specifikusan hasítja a kiméra mRNS helyett dokkoló szekvenciák a két gén képes volt gátolni expressziójának bcr / abl kiméra gént a tenyésztett sejtekben. A ribozimek expresszióját tenyésztett sejtekben okozott csökkenését bcr / abl mRNS szinten, teljesen blokkolta a kialakulását a kiméra protein p210 bcr / abl és gátolta a sejtek növekedését 84% -kal. Ezek az eredmények szignifikánsan jobb által kiváltott oligonukleotidok.
Más kutatók kapunk ribozim elhasítja a fenti kiméra RNS kodon GUU, szomszédságában található a bázis dokkoló szekvenciákat a két gén. Ez a ribozim pusztító RNS megfelelő in vitro és in vivo, és gátolta a tirozin-kináz-aktivitását P210 fehérje.