Valence klórt FeCl2, felc3, milyen szórakoztató!
Valence az a képesség, a sejteket letapadni, hogy a többi elem.
Azaz, a vegyértékével -. Száma mutató számos olyan elemet, amely rögzítse magát az adott atom. Száma határozza meg a párosítatlan elektronok gerjesztett, és gerjesztett atomok.
A klór egy eleme a hetedik főcsoport podrugppy, a harmadik időszak a periódusos rendszer a kémiai elemek. Az atomi száma klór - 17. kiírja mindkét Cl Chlorum. A klór az aktív része a nemfémes és halogén-csoport.
Vegyértéke és oxidációs állapotát klóratomok molekulájában

Az oxidációs numerikusan kijelölt abban az állapotban az atom a vegyületben. is nevezik oxidációs száma. Annak meghatározása, amely hagyományosan úgy vélték, hogy egy egyszerű kovalens vegyületek pozitív energia érték egyenlő az elemek száma oxidációs levonni az atomot kötő elektronpár, és egy negatív értéket az oxidáció mértékét - száma pull elektron pár. Ezért mértékének meghatározására oxidációs úgy vélik, hogy a vegyületek, melyek csak a pozitív és negatív töltésű ionok.
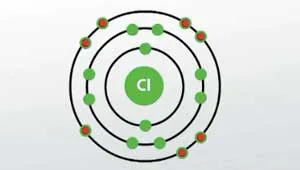
Beszéd klórt, vegyértéke és oxidációs állapotban a molekulában, a következő értékeket:
- Vegyértékével - 1.
- Az oxidáció mértéke - 0
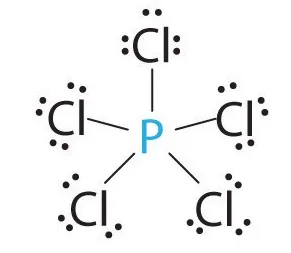
Vegyértéke foszfor szilícium nitrogén
Mi a vegyérték más anyagok gyakran kölcsönhatásban klórral?
- Leköti a nitrogén. Nitrogén a periódusos betűvel N. Ez ACCE lények formájában valenciájú függően a vegyület. Ez megfelel még a frakcionált vegyértéke. Ez is lehetséges, hogy megnézi az nitrogén oxidációs példa: N2O - egyértékű nitrogén (kéjgáz) NO - kétértékű. NO2 (nitrogén-dioxid, barna gáz). Nitrogén vegyületek, oxidációs állapotban +5 - nitrogén-oxid (V) N2O5, salétromsav és sói - nitrátok, et al.
Mindazonáltal, leköti a nitrogén = 3.
- Foszfor (P) van a 3. harmadban, V csoport, a fő alcsoportok a Mendeleev periódusos rendszer. vegyértéke foszfor is eltérő lehet, mindent, mint bármely más anyag, nyugszik sőt bármely kémiai anyaggal megtörténjen foszfor kötést. Mindazonáltal, a vegyértéke foszfor samog III, V.
- Szilícium (Si) - egy 3-időszak, IV-csoport a fő alcsoportja a periódusos rendszer. Valcncy - 2, 4.
Vegyértéke klór szerves vegyületek, a gerjesztett állapotban a hidrogén-klorid, a felső-oxid
Vegyértéke klór szerves vegyületek különböző lehet, attól függően, valójában a vegyületet.
A fő reakció a klórt szerves anyagok:
- C telített vegyületek:
CH3-CH 3 + Cl2 → C2H5Cl + HCI
- Csatlakozik a telítetlen vegyületek többszörös kötések:
CH2 = CH2 + Cl2 → Cl-CH 2-CH 2-CI
- Aromás vegyületek szubsztituált egy hidrogénatomot klórral reagáltatjuk egy katalizátor (például AICI3 vagy FeCl3):
C6H6 + Cl2 → C6H5Cl + HCI
A undriven állam klóratom energia szintet 3 jelentése 1 páratlan elektron így gerjesztett klóratom mutathat vegyértéke 1.
A gerjesztett állapotban - vegyértéke 3.
Magasabb-oxid egy oxid, ahol az elem mutat a magas fokú oxidáció.
Cl2O7 - klór-oxid- (VII) - Art. oxidálódott. Cl (+7) - Principal oxid.
Valcncy klór- fémekkel, foszfor, ezüst, nátrium, hidrogén, oxigén, kalcium, alumínium, egy nem-fémek, vas
Általában vegyértéke - az egyik legbonyolultabb témákat kémia kitalálni, van egy csomó anyagot elolvassa. Nem tudván, az alapvető törvények és szabályok a kémia, senki sem érti, mi az a vegyérték, sokkal kevésbé megtanulják, hogyan kell azonosítani.
Kölcsönhatás fémek:
A klór közvetlenül reagál szinte minden fém, azonban bizonyos reakciók igényelnek nedvesség vagy hő.
Kölcsönhatás nemfém:
C nemfémek (kivéve szén, nitrogén, fluor, oxigén és inert gáz) képeznek megfelelő kloridok.
A különböző vegyületek különböző vegyérték, mint a klór, fémekkel (ezüst, nátrium, vas, alumínium) vegyérték-klór- = 1, a nem-fémek, amelynek más vegyérték, de a leggyakrabban, szintén 1. A vegyületek hidrogén-kloriddal vegyértékei = 1.
Általában CL mindig van egy vegyértéke, 1, kombinálásával olyan anyagokkal kivételeket anyagok vegyértékű VII.