6 Foszfor, foszfidok
Foszfor, foszfidok. -foszfin. foszfor-oxidok a (III) és (V). Orto-, meta- és a pirofoszforsav. Ortofoszfát. Foszforsav-észterek
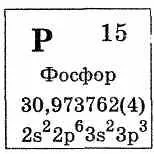
6.1. Foszfor, foszfin, foszfát
Mint a nitrogén, foszfor - a nemfém, de a nemetallichnost nem annyira hangsúlyos, tovább. A fő oka ezeknek a különbségeknek, arra a következtetésre jutunk nagyobb atomi sugár és a megjelenése d-pályák a külső réteg. Növelése az idő-intézkedés atom vezet gyengülését a külső-kapcsolat van elektron a sejtmagban. Ez ahhoz vezet, hogy könnyen-edik átmenet az elektronok a gerjesztett állapotban, és teszi a kémia elem jelentősen eltér a nitrogén kémia. Ez általában akkor lépnek fel, mint a megnyilvánulása rejlő közönséges fémek. Ellentétben a nitrogén, a foszfor és nem gáz, hanem egy szilárd, kristályos szerkezetű. Az egyik a sok allo-tropikus módosítások - fekete foszfor - félvezető. Kis-lorodnye vegyületté, hogy tartósabb, és az oxidatív-TION funkciók a vegyületek, ahol lehetséges oxidációs állapotban 5, teljesen hiányzik mind oxidok és y savak.
* Mivel a természetben
A leggazdagabb a világon apatit betétek találhatók, közel a város Kirovsk a Kola-félszigeten. Foszforitot eléggé elterjedt, Nena az Urál, a Volga-vidéken, Szibéria, Kazahsztán, Észtország, Be-lorussii et al. Nagy betétek foszfát Észak-Afrikában, Szíria és az Egyesült Államokban.
Foszfor elő apatit vagy foszforitot. Friss kevert szénnel (koksz), és a homok, kalcinált elektron-paraméter-kemencében 1500 ° C-on
foszfor keletkezett gőzök kondenzáljuk a vevő víz alatt.
Foszfor létezhet számos módosítást. Az on-ér, ott legfeljebb 11 allotropic formákat. „Sok arcok” a foszfor azonban csökken három fő típusa van: fehér, vörös és fekete.
A leggyakoribb módosítás fehér foszfor - színtelen, viasszerű és nagyon mérgező anyag, amelynek tplav = 44,1 ° C, és forráspontja = 280 ° C-on A víz, ez gyakorlatilag oldhatatlan, de vízgőz elég könnyű, hogy egy gázkeverék. Ez oldódik éterben, benzolban, terpentin és a zsíros olajok, de a legjobb a szén-diszulfid. Súrlódás hatására meggyullad, ezért darabokra vágjuk csak a víz alatt. A sötétben világít Hosszantartó g melegítés (250 ° C), fehér foszfor válik piros.
* Piros foszfor - por vörös-barna színű, ez teljesen ártalmatlan. Kevésbé aktív, mint a fehér foszfor, vízben oldhatatlan, és a szén-diszulfid, izzik a sötétben. Ez jelenti a keveréket több allotropic módosításról, amely eltérő a színe (a lila bíbor) és néhány más tulajdonságát.
^ Fekete foszfor - a legstabilabb forma az elem. Megjelenésük hasonlít fém: a vas egy szín színű, fémes csillogású van metalliches Coy elektromos vezetőképesség, a keménység és a hővezető képessége. A nevét az aktív szilárd formák elemi foszfor. övé
akkor vágott a levegőben, mintha felgyújtották a mérkőzés, a fekete foszfor világít nehezen.
Kiderült fehér foszfor elhúzódó melegítés közben 200 ° C-on és nyomás 1200 MPa.
Tulajdonságok allotropic módosítások foszfor magyarázza a szerkezetüket. Vizsgálták részletesebben a szerkezet a fehér foszfor. Ez egy molekuláris rács. Molek His-ly chetyrehatomny (P4 - tetraphosphorus), és a megfelelő alakra sósavat háromoldalú piramis.
Mindegyik foszfor atom egyik a csúcsai a piramis, és kapcsolódik a három pi-kötések három másik atom. Vörös és fekete foszfor poliatomos kristályrács.
foszfor atomok lehet kombinálni P2 molekulák. P4 és polimer anyagok.
Kémiai foszfor aktivitása jelentősen nagyobb, mint a nitrogén.
Foszfor Könnyen oxidálódik oxigén: oxigén-feleslegben razuetsya foszfor-oxid (V), és a hiány - foszfor-oxid (III):
Az oxidációs reakció során a levegő-kibocsátó azt, azaz a Kemilumineszcencia történik (fénykibocsátás kémiai reakciók).
Foszfor reagál számos egyszerű anyaggal E - halogének, kén, és egyes fémek, és bemutatja az oxidáló és redukáló tulajdonságai. Vegyületek Phos nevezett handicap fém-foszfid.
Foszfor olyan vegyületeket biztosít, és az átmeneti csoport elemek azok azonos V csoport: VP, VP2. NBP, NbP2. Ez indítja, TAP2.
Erős oxidálószerek foszfor alakítjuk foszforsav:
Reakció fehér foszfor jobbak, mint a vörös.
Foszfor normál körülmények között nem reagálnak a hidrogénnel, így foszfor-vegyületnek hidrogénnel - foszfin - kapunk vagy foszfor-alkáliák:
P4 3KON 3H2 O = PH3 3KN2 PO2 vagy foszfidok reagáltatásával vízzel:
Foszfin PH3 - színtelen gáz a szaga „rothadt hal”. Mérgező, gyúlékony és robbanásveszélyes keverékeket képezhet, bizonyos állapot-ditions. Foszfin-CIÓ szokásos hőmérsékleten nem bomlik, de magasabb hőmérsékleten, és az oxigén távollétében bomlás következik be, hogy jelentős mértékben:
Gyengén oldódik vízben: 1 térfogat-foszfin feloldunk 4 térfogatrész vízzel. Ismert nagyon instabil kristályos Phos-Final PH3 • H2 O, a megfelelő készítmény-hidroxid pH = 4 OH, -od Nako bázis tulajdonságai ennek a vegyületnek nincs.
Foszfin sók hasonló szerkezetű az ammónium-sók, a kifizető-a kölcsönhatás egy erős oldatot hidrogén savak gázalakú foszfin. Mint képest ammónium sók kevésbé stabilak.
PH 4 SlO4 foszfónium-perklorát robbanásveszélyes, halogenidek és tökéletesen elbomlik hevítésre: PH3 = Cl pH sósavval 4
Bizonyos arányok az oxigén és az elegyet autoignites PH3:
Foszfin - az egyik legerősebb redukálószerek. Ő újragenerálása navlivaet fémsók oldatban a foszfidok, és bizonyos esetekben a fémek:
Mivel a foszfor-halogenidek foszfin reagál, hogy kiadja a közepes szabad foszfor-:
Piros foszfor használják a mérkőzés iparban. Piros foszfor, antimon-szulfid (III), vörös vas-oxid (természetes oxid vas (III) elegyített kvarc), és a ragasztó-smokk ember készítsünk keveréket visszük fel a oldalfelületei a spin-szálú box. Head meccsek főleg kálium-klorit-rata, csiszolt és ragasztó. Súrlódás által a fej terjed matchbox vörös foszfor meggyullad, meggyullad része a fej, és a világítást fa.
A fehér foszfor széles körben alkalmazható. Általában előállítására használják füst képernyők. Fekete foszfor at-változás nagyon ritkán.
^ 6.2. foszfor-oxidok a (III) és (V)
Foszfor képez az oxidok számának, amelyek közül a leginkább tanulmányozott és fontos gyakorlati szempontból, foszfor-oxid (III) P2 O3 és foszfor-oxid (V) P2 O5.
foszfor-oxidok a (III) és (V) van egy közös jellemzője. Annak megállapítására, hogy igaz formula kiderült, hogy ők is párban dimerek. Képletek kell írni az alábbiak szerint: a P4 és P4 O10 O6. Ennek oka az előfordulása, mint egy kissé szokatlan szerkezet-képződés-hőmérséklet néhány kutató arra törekszenek, lásd-SRI foszfor tartani P4-molekula szerkezetének, és további alkotnak tetraéder, a közepén volt található a foszforatomhoz és az oxigén atomok a sarkoknál. Ez a szerkezet különbözik etsya nagyobb szilárdságú, és tárolják a további stabil O-savak a foszfor és a foszfátok.
^ Foszfor-oxid (III) P2 O3 (P4 O6) - Ceska viaszos kristályos anyagot kapunk, amelynek olvadáspontja 23,8 ° C, könnyen oldódnak szerves-nikai oldószerek. Nagyon mérgező. Való elégetésével kapott foszfor-körülmények között korlátozott oxigén:
Szerint a kémiai tulajdonságai P2 O3 savas hidroxi-ház reagáltatásával vízzel szobahőmérsékleten formák foszforossav:
De elég kicsi ahhoz, hogy a hő helyett hidrát-CIÓ volt redox folyamat:
A reakciót az alkálifém-só formák: 4NaOH P2 O3 = 2Na2 HPO3 H2 O
foszfor-oxid (III) rendelkezik regeneráló tulajdonságait MI: oxidált oxigénnel P2 O5. P2 O3 O2 = P2 O5
^ Foszfor-oxid (V) P2 O5 (P4 O10) - hygro-fehér morzsolódó skopichny por, laza, amíg bolyhos. Nyert az első-rénium foszfor többlet levegő vagy oxigén:
Nagyon vízzel heves reakcióba lép, hogy így a foszfor-vajsav:
Ez a tulajdonsága a P2 O5 lehetővé teszi, hogy használja azt széles körben használt hatékony vízelvonó szer.
Ez képes átalakítani kénsav és nitrogén-oxid:
Az alap-oxidok reagál csak fúzió:
Reagál bázisokkal:
^ 6.3. Orto-, meta- és a pirofoszforsav. ortofoszfát
foszfor-oxid (V) P2 O5. kölcsönhatásban vízzel, formák NRO3 meta-foszforsav; az utóbbi formák során forrásban
^ 23. táblázat Foszforsav
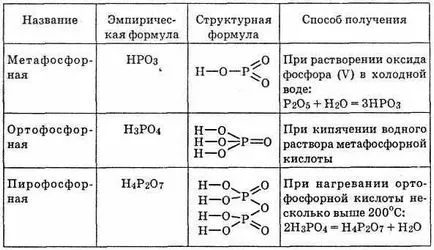
ortofoszforsav H3 PO4; melegítésével H3 PO4 képződött difoszforsav (vagy pirofoszforsav) sav H4 P2 O7 (lásd. táblázat. 23.).
Metafoszforsav-és instabil a tiszta formában nem te-eloszthatók, valamint megoldások nem izoláljuk sójából. Létezhetnek polimer (NRO3) n. Továbbá lehetséges mák-makromolekulák, kezdve a polimerizációs fok n = 3. metaphos-Forney sav nagyon erős, az összes hidrogén-ionok ott disszociációs-th e. Ezek azonban nem jellemző semmilyen oxidáció vagy redukció a minőség. Víz makromolekula metafoszforsav-hasítunk H3 PO4.
Így, metafoszforsav savak nem stabilak, és pre-höz egy csak közbenső szakasz reakció-TION-hidrát foszfor-oxid (V) P2 O5.
^ Foszforsav H3 PO4 - a legstabilabb az összes sav öt vegyértékű foszfort. Ez egy színtelen, kristályos szilárd anyag olvasztható anyagot. A kristály-ly alakulnak szirupos massza a levegőben. Nem-toxikus-ta. Mivel a víz kevert bármilyen arányban. Normál hőmérsékleten inert, nem térül meg a szén és még vodoro-házban. Ez nem mutatott oxidáló vagy redukáló tulajdonságokkal. De amikor melegítjük reagál fémekkel és oxidjaik, hat a kvarc és még aranyat.
Mint azt egy átlagos sav erőssége. Fejti ki Kitty lotnye tulajdonságait, amikor kölcsönhatásba lúgokkal:
Az iparban, ortofoszforsavat kétféle eljárással állítják elő: extrakció és termikus. Az első módszer aprított kalcium-foszfátot kénsavval kezeltük:
CaSO 4 kicsapódik, a csapadékot és a savas oldatban marad. Így a savas oldatba mozgó sok szennyeződést - szulfátok vas, alumínium. Ez a sav a műtrágyák előállítása.
A második módszer, az első, a foszfor (RECOV-niem természetes foszfátok). Ezután oxidált P4 O10. és POS-Lednev kölcsönhatásba lép a vízzel. G tiszta sav (koncentrációja 80%).
A ortofoszforsav molekula hidrogénatomok kapcsolódik egy oxigén-HN atomok:
A vizes oldat, ortofoszforsav megy disszociációs STU-tipikus ugrásválasz:
Lépés: N HPO 4 2- PO 4 3-
Általában uralja a disszociációs lépésben. Mivel a tribázisos, hogy sót képezzenek - ortofoszfát három típusa van:
1) foszfát - szubsztituált összes hidrogénatomok a foszforsavat (K3 PO4 (NH4). 3 PO4);
2) hydrogenphosphates - szubsztituált két savval hidrogénatom (NRO4 K2 (NH4.) 2 HPO4);
3) dihidrogén-foszfát - helyettesített egy hidrogénatomja a sav (KH 2PO 4 NH4 2PO 4) ..
Minden foszfátok alkálifémek és ammónium vízben oldható. Mivel a kalcium-foszforsav-sókat vízben oldjuk, csak Ca (H2 PO4) 2 - dihidrogén-foszfát. Kalcium-hidrogén-foszfát CaHPO 4, és kalcium-foszfát Ca3 (PO4) 2 oldódnak szerves savak.
Ortofoszforsav értékes műtrágya.
Szuperfoszfátok - keveréke CaSO 4, és a Ca (2PO 4) 2 • H2 O. nyeréséhez betétek természetes foszforitot szuperfoszfát kénsavval kezeltük:
^ Szuperfoszfátok Dual Ca (2PO 4) 2 úgy állítjuk elő, sav hatására Phos-Forney természetes kalcium-foszfát:
A csapadékot CaHPO 4 • 2H2 O vízben oldhatatlan, de oldódik etsya a savas talajok. Net csapadékot felhasználásra MINŐSÉG Island fosfornoizvestkovoy adalékanyag szarvasmarha-takarmány. Előállítva kalcium-hidroxid:
Ammofos - keveréke NH4 2PO 4 és (NH 4) 2 HPO4 - értékes műtrágya-készlet tartalmazó nitrogén és a foszfor. Állítjuk elő, am Miaka foszforsavval.
nátrium-dihidrogén-foszfát-NaH 2PO 4 használják a gyógyászatban.
^ Pirofoszforsav H4 P2 O7 egy lágy üveges tömege (op = 61 ° C), vízben könnyen oldódik. Kis-tetrabázisos sokat, és erősebb, mint a foszforsav.
^ 6.4. Foszforsav-észterek
A szakirodalom számos pro-szerves származékai foszforsav. Ez Észterek azok mól-kuls áll egy radikális és egy anion egy szerves alkohol-foszfor-sav. Némelyikük rendkívül fontos a szervezet számára. Például, foszfátok cukrok:
vagy származékai glicerin és foszforsav:
Foszforsav-észterek cukrok játszanak fontos szerepet fotoszintetikus-se és a metabolizmus, és glicero savak részt az átalakítás a zsírt.
Vegyületek, amelyek a maradék a két sav és köl-ható a víz alkotja sav említett KKV-
shannym anhidridet. Az ilyen anhidrid létezik ecetsav és a foszforsav:
Kommunikálni könnyen törik közöttük. Hasonló folyamat játszódik le a természetben a fehérjeszintézisben.
A két legfontosabb élő szervezet sav - DNS (dezoxiribonukleinsav) és RNS (ribonukleinsav) - pre-höz egy hosszú láncú, sodrott spirálisan és társ-Állandó váltakozó szénhidrát vagy foszfátcsoport. A hidrolízis Ezen savak bomlanak külön szénhidrát-foszfát lánc.
Egy másik fontos fajtája biológiailag fontos Conn-Neny vannak fosforproteidy. A képviselő az ilyen típusú együttműködés egység - kazein a fő része túró és sajt.
Jelentése szerves foszfortartalmú molekulák földi életformák kizárólag. Ezek alapján készült a szükséges munka-May „biológiai gépek” a test. A titok abban rejlik etsya magas energiatartalma az foszfát P-O kötéseket. Koh yes adenosinetriphosphate hasítjuk az intézkedés alapján vízmolekula a H3 PO4. ez áll mintegy 50.000 kJ (per 1 mol). OSZTÁLY molekula H3 PO4. SINGLE-adjunction olyan molekulát az organo-anyag-etnikai, Prien szitán energiában gazdag kötés. Egy ilyen szerkezet könnyebb belépni a szerves foszfor részben chi-dasági átalakulás - ez több tevékenységet. Így, az energia-bo-gatye kommunikációs fordulhat-schatsya egy molekula egy másik, és az energiát szolgáltatunk a szervezet összes sejtek (lásd. Ábra. 21).
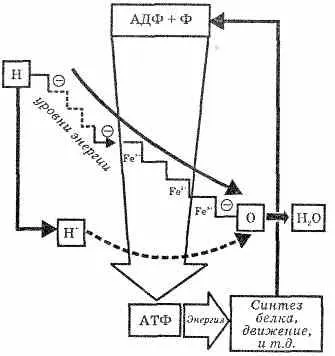
21. ábra. Reakcióvázlat konvertáló adenozin-triphosphoric (ATP) és az adenozin-difoszfát (ADP) savak a szervezetben.