A mérés az elektród potenciál

Home | Rólunk | visszacsatolás
Jelenleg nincs módszer, hogy mérni az abszolút értéke a potenciálja az egyes elektród, de meghatározható hagyományos kvantitatív értékét az elektród potenciál tekintetében bármely más elektród, amely ki van választva, mint a referencia elektród.
Mivel a referencia elektród van kiválasztva, és ma már standard hidrogén elektród.
Egy ilyen elektród tartalmaz egy platina fóliával oldatába merítjük tartalmazó hidrogén ionok és amely folyamatosan mossuk a hidrogéngáz. Gáznemű a hidrogén 1 A atmoszféra nyomáson és aktivitásának hidrogén ionok az oldatban 1 ((uproschenno-, amikor a koncentráció = 1).
A következő reakció játszódik le a hidrogén-elektród:
1, tartalmazó oldatot H + ionok (aH + = 1)
2- elektrolitikus kulcs (só-hidat)
3 elektróda potenciál mérjük,
4- elektrolitikus kulcs (cső az elektrolit oldat)
Az elektróda potenciál a EMF a cella, amely egy adott elektróda és egy standard hidrogén elektród
Ha megfelelően használják, a pH-elektródát adhat nagyon pontos eredményt, reprodukálható 0.00001V. De a nagy érzékenység (függőség), hogy a külső feltételek erőteljesen akadályozza annak használatát, ezért, egy másik elektróda stabilabb pontosan ismert elektród potenciál használjuk referenciaként helyett hidrogén-elektród. Az egyik leggyakoribb - klór-ezüst elektróda, amely egy ezüst huzal bevont AgCl és merítjük KCl oldatban (általában - telített).
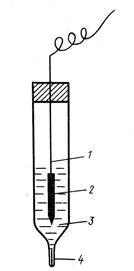
1- ezüst huzal,
2 - ezüst-klorid,
4 - Elektrolitikus kulcs (töltött kapillárisban porózus inert
anyag impregnált KCl oldat)
A sejt-2 részből áll, amelyek mindegyike tartalmaz egy elektródát. Megváltoztatása az egyik darabot, akkor létrehozhat egy egészen más galvánelemek.
Elektromotoros ereje elektrokémiai cella (elektromotoros erő) az a maximális értéke a potenciális különbség az elektródák között:
Hol vannak jc - katód potenciál,
ja - a lehetséges az anód.
Oxidáció történik az anódnál és helyreállítási - a katódon.
Példa felvétel elektrokémiai cellában, amely tartalmaz egy elektródával oldatban Zn és Cu elektróda ZnSO4 CuSO4 az oldatban:
(-) Zn çzn 2+ ççCu 2+ çCu (+)
(-) Zn çZnSO4 ççCuSO4 çCu (+)
Zn çZn 2+ egy lehetséges ugrás határán a fém-fém ion-oldatot
ZnSO4 ççCuSO4 mutatja diffúz ugrás elektród potenciál a két megoldás között.
Diffúziós potenciál a potenciális különbség keletkező közötti határfelületen a 2 megoldásokat eltérő formában vagy oldott anyag-e annak koncentrációját.
A maximális hasznos munkát sejt. Elvégzése során reverzibilis reakcióját bármely elhaladó állandó hőmérsékleten és nyomáson nyert ez működni fog a maximális munka A'max reakciót. Által végzett munka egy galvanikus elem ilyen körülmények között, az EDS elem szorozva a villamos energia mennyisége telt el. Fogjuk kifejezni mennyiségét anyagok vannak kitéve transzformációk eredményeként reakciók egységekben Gram-atomok elem (vagy Gram-ion-komplex ionok). A villamos energia mennyisége, amely megfelel egy ilyen átalakítás (c-c-atom vagy ion) egyenlő NE × F coulomb
Hol vannak ne - ion töltése,
F = 96.487 coulomb / mól (vagy Kd × mol -1) - állandó (integer) Faraday
(Fizikai értelmében a Faraday - töltés 1gramm atom (vagy ion) anyag).
ahol W'max - kijelölés munka Elektrokémiai.
b × B + d × D Û q × q + r × R
E = - = = E o - ln
E = E o - ln - Nernst-egyenlet.
E o - EMF a cella standard körülmények között, amikor cB = CD = CQ = Cr = 1
Az érték E o - úgynevezett normál (vagy normál) EMF elem.
Ha vesszük az elektrokémiai cella egy standard hidrogén elektród potenciálját, majd a fém elektród egyenlő: J = j o + lncM
Hol vannak j o - standardpotenciál - azaz potenciális amely akkor következik be, amikor a tevékenység (koncentráció) a fém ionok egyenlő egységét.
Számítsuk ki az elektród potenciálja különböző fémek a saját só különböző koncentrációjú vizes oldatainak alkalmazásával lehetséges a Nernst-egyenlet és értékeit standardpotenciál a fémek, amely megtalálható kézikönyvekben.
Standardpotenciál különböző elektródák lehet elhelyezni egy úgynevezett feszültségtartományt - elektrokémiai sorban a fémek aktivitása (száma standardpotenciál) - a sorrend, amelyben a fémek vannak elrendezve növekvő sorrendjében, standard elektrokémiai potenciálok # 966; 0. megfelelő felezési reakció csökkentésére egy fémkation Me n +:
Me n + + n # 275; → Me
Számos stressz jellemzi a relatív aktivitását fémek redox reakciók vizes oldatokban.
A nemzetközi szakszervezeti IUPAC (Union Pure and Applied Chemistry) feltételezhető, hogy a potenciális fémek tekintetében a standard hidrogén elektród negatív vannak írva a „mínusz”, mielőtt azok értékét. Ha a fém, tekintettel a standard hidrogén elektród - pozitív, annak értéke rögzítve a plusz jel.
Polarizációs - eltérítéséhez elektród potenciál annak egyensúlyi értéket, amikor az elektromos áram. Polarizációs csökkenti az EMF a sejt és az elektrolízis arány.
Koncentráció polarizáció lép változása miatt az ion-koncentráció közelében az elektród felülete által az elektrokémiai reakció:
A koncentrációja Zn 2+ ionok növekszik
A koncentrációja Cu 2+ ionok csökken
Kémiai polarizáció miatt előfordul, hogy egy állapotváltozás (jellege) a felület az elektród hatása alatt elektrokémiai reakció termékek (a anyagok kialakulását az elektród felületén, amelyek akadályozzák az elektrokémiai reakció):
2H + + 2e ® H2 - (lefedi az elektród felületén)
A reakció lehet egy fém-elektród változás „hidrogén” (például egy réz elektród lehet „átalakított” egy hidrogénatom)
Dj = j o H2 - J o Cu = - 0,337 V
Mindkét típusú polarizációs csökkenteni lehet különböző módszerek, amelyek úgynevezett depolarizáció.
A koncentráció-polarizáció jelentősen csökkenteni lehet intenzív keverés közben. Kémiai polarizáció csökkenteni lehet olyan anyagok hozzáadásával, amely reagál ezen anyagok, amelyek miatt polarizáció. Például, mint a depolarizátor a reakciót, ami a hidrogén-gáz felszabadul, lehetőség van alkalmazni a hidrogén-peroxid, és csökkenti depolarizáció: