Anódos oldódás - kémiai enciklopédia
Anódos oldódása a fém. elektrokémiai. oxidációja a fém a p-D vagy olvadt elektrolitot alkotnak egy p - oldható termékek és visszavonása felszabadult elektronok egy külső. láncban. Általánosságban elmondható, hogy ez a folyamat lehet írni a következő. módon:
ahol M jelentése fématom. n-számú felszabaduló elektronok. Összhangban Faraday-törvény. ., Stb a távollétében a p-elektród TIONS közötti függőség az oxidáció sebességét a fém V [g / (cm 2 * s)], és a sűrűsége anódos áram i formában van:
Anódos oldódás alapján elektrokémiai dimenziós. feldolgozása fémek és ötvözeteik, valamint elektropolírozáshoz, keményedés anód fémbuga. anyag eltávolításával egy vékony povet mechanikusan deformált. rétegek segítségével p - oldható anód során elektrokémiai. finomítás fémek és galvanizáló. Anódos oldás segítségével. exp-függő luatats. galvanikus tulajdonságai. elemek és akkumulátorok. valamint a korróziós viselkedését a szerkezet. fém blokk. anyagokat.
A legfontosabb jellemzőit az anód-kioldódási i függés elektródpotenciál E és a parciális derivált inverz kapcsolatot. hívott. polarizálhatóságot és mivel tehn. jellemző oldódó anódok. Ezek a függőségek lehet koncentrációt. vagy kinetikus. (Aktiválás) természete. Amely esetben valósul meg a gyakorlatban ez függ a kapcsolatát i és E egy adott áram io csere. azaz áramsűrűség egyensúlyi potenciálja, amikor ez pontosan megegyezik az áramsűrűség a fordított folyamat - a katódos fém lerakódását. i
ahol E - a standardpotenciál. [M n +] - alsó felülete a fémion koncentráció. T absz. temp, R-gázállandó. Ugyanakkor a fennmaradó egyensúlyi potenciál változik, mivel [M n +] y-STI öntettel arányosan növekszik az anódos oldódási sebesség (vagyis, az áramsűrűség i). Volt. függése E ur-i leírt Niemi:
ahol K - empirikus. együttható. Ez ur-set mb Ez törött, amikor a határ p-rimosti só érhető el. kialakítva, egy fémmel az elektrolitból anionok. és [M] megszűnik növekedni. Ha a kapott csapadékot laza és nem jelentősen megakadályozzák az aktuális, a további fém gyakorlatilag nem polarizálható. Az ilyen, például a. jellege a nem polarizálható otritsat. ólom akkumulátor lemezeket.
A vizes elektrolitok p-PAX polarizálhatóságot leírt koncentráció. írja jellemző átmeneti fémek a I. és II (Ag, Cu, Zn, Cd), a szem jellemző io magasabb értékeket. Legfőbb jellemzője - a függőség E nemcsak én, hanem a keveredés intenzitásának p-pa.
Amikor i> IO oldódási bevételt kinetikus. szabályozás, azaz a Ez szorítkozott elektrokémiai. lépés - a átadása töltött részecskék segítségével a fém-rr, és a sebessége változik a potenciális E a törvény:
valahol így. hívott. együtthatók. transzfer. Ez a típus polarizálhatóságának különösen jellemző a csoportba tartozó átmenetifémek (Fe, Ni, Co, stb), To-jellemző az alacsony értékei io.
A korlátozó szakaszban, és így az egész folyamat nagy mértékben befolyásolják annak előző lépés adszorpciós és kémiai. kölcsönhatást. felületi fém atomok a komponensek r-ra (p-erator molekulák, elektrolit anionok). Tekintettel ebben a szakaszban, és a mechanizmus a anódos kioldódási sebesség a következőképpen fejezhető ki:
ahol A - jelentése adszorbeálódó komponenst r-ra, és m az a szám, annak molekulák. a folyamatban részt vevő, K1 - konstans. Attól függően, hogy az adszorpciós körülmények között serkentik vagy gátolják anódos oldódás (t m. B. Pozitív vagy negatív). Volt. beadását RR vagy eltávolítását belőle az adszorbeált komponensek - az egyik leghatékonyabb módszer a szabályozó kioldódási sebessége az anód a szakterületen. A stimulánsok széles körben használják dimenziós elektrokémiai technológia. fémek. valamint, hogy csökkentsék a polarizálhatóságot oldható anódok. Egy kioldódási inhibitora az anód - az egyik legfontosabb módszer, hogy megvédje fémek korrózió ellen (lásd korróziógátlókat.).
Anódos oldódás. végtermékek to- több vegyértékű kation, vagy azok komplexei, áramlik általában egy sor egy-elektron lépések (n - 1), amelyek mindegyike a körülményektől függően lehet korlátozó. Ugyanakkor a közbenső. fémionok az alacsony oxidációs állapot gyakran dookislyayutsya, hogy ne csak egyensúlyi állapotban (néha kevésbé) elektrokémiai úton, hanem ennek eredményeként a közvetlen kölcsönhatás. oxidokkal. r-RA komponens (oldott oxigén molekulák. H + ionok), például. p-CIÓ:
Ezekben az esetekben a teljes sebességgel anód oldódás jelentősen meghaladja a számított érték a jelenlegi csak.
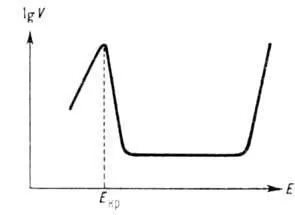
Gyakran bonyolítja másodlagos anódos oldódás jelenségek. Így, a formáció a kötszer-sti feloldjuk a fém fázis vagy adszorpciós sója vagy oxidos passziváló réteg vezet anódos oldódás (lásd. Passzivitás fémek) a-menny nyilvánul a gyengülése a sebesség függ a kapacitás elérése érdekében oldódási áramsűrűség határértéknél. és néha változtatni típusától függően. A vizes közegben nőtt. hajlandóság passivate különböznek tovább. átmeneti fémek (Mo, Cr, Ni, Fe, stb). Jellemzőjük a kritikus. potenciális Ecr. jellegétől függően a fém és a pH-r-ra. Amikor elérte Ecr szokásos növekedése anódos oldódás sebességét helyébe éles alsó, néha akár több. nagyságrenddel. Ezt követően, egy nagy tartományban potenciál értékének anódos oldódási sebessége állandó értéken tartjuk, majd elkezd exponenciálisan növekszik a potenciál (lásd. Ábra.). Az utóbbi jelenség ismert superpassivation miatt egy új folyamat anódos (oxidáció, hogy a fém ionok a magasabb vegyérték) a-nek ez az alapja elektrokémiai. technológiát előállító nagyobb oxigén Port. számos fémek. pl. Mn, Cr. Amikor az ötvözet anódos oldódása lehetővé egyenetlen átmenet összetevőinek p-p, azaz szelektív oldódás, az egyes alkotóelemek és gazdagítja a felszínen a ötvözet réteg többi.
===
App. Irodalom a cikk „anódos oldódás.” Kolotyrkin YM "Nature", 1979, 11. szám, pp. 2-13: saját ".Zaschita fémek", 1983, 19 m, № 5, pp .. 675-85; Alapjai az elmélet és a gyakorlat elektrokémiai megmunkálás fémek és ötvözetek. M. 1981. JM Kolotyrkin.