Az entrópia könnyű!
Ez az üzenet egy szabad fordításban a válasz, hogy Mark Eichenlaub adta a kérdést Mi intuitív módon érthető entrópia?. megadva az oldalon Quora
Az entrópia. Talán ez az egyik legnehezebben érthető fogalmak, amelyekkel találkozhat során a fizika, legalábbis amikor a klasszikus fizika. Kevés fizikai képességeit diplomások tudja magyarázni, mi az. A legtöbb probléma a megértés az entrópia azonban el lehet távolítani, ha érti, egy dolog. Az entrópia minőségileg különbözik a többi termodinamikai mennyiségek: mint a nyomás, térfogat, vagy a belső energia, mert ez nem egy tulajdonság a rendszer, és hogyan nézzük ezt a rendszert. Sajnos, a kurzus a termodinamika ez általában kezelni egy par más termodinamikai függvények, amely hozzájárul a félreértés.
Tehát mi az entrópia?
Dióhéjban, a
Entrópia - így sok információt nem tud a rendszer
És mi van, ha azt mondanám, hogy az összeg egyenlő 59? Erre macrostate már csak 10 lehetséges mikroállapotok, úgy, hogy annak entrópia egyetlen karakter. Mint látható, a különböző különböző macrostate entrópia.
Most hadd mondjam el, hogy az összeg az első öt csontok 13, és az összeg a fennmaradó öt - 17, így a teljes összeg több mint 30 van, azonban ebben az esetben több információ áll rendelkezésre, így az entrópia a rendszer az Ön számára kell esnie. És tényleg, 13 öt csontok kaphat 420 th különböző módon, és 17-780-én, azaz az összes mikroállapotok potom 420h780 = 327 600. Az entrópia egy ilyen rendszer körülbelül egy karakter kevesebb mint az első példában.
Mérjük az entrópia a karakterek száma köteles rögzíteni száma mikroállapotok. Matematikailag ez határozza meg, mint a logaritmus számát, így a szimbólum jelöli az entrópia S, és a szám a mikroállapotok szimbóluma w, írhatunk:
Ez nem más, mint a Boltzmann képletű (akár egy tényezője, k, ami függ a választott mértékegység) a entrópia. Ha macrostate megfelelnek egy mikroállapot, annak entrópia képlet szerint nulla. Ha két rendszer, a teljes összeg entrópia entrópia minden rendszer, mert log (AB) = log A + log B.

A leírás eredményezett fenti világossá válik, hogy miért ne gondoljon az entrópia a rendszer, mint a saját tulajdonát. A rendszer opedelonnye belső energia, lendület, töltés, de ez nem egy bizonyos entrópia: entrópia tíz csontok függ egyetlen ismert, hogy ha a teljes összeget, vagy pedig a részösszegek csontok ötös.
Más szóval, az entrópia -, hogy hogyan írják le a rendszer. És ez így sokkal különbözik a többi mennyiség, amely lehetővé tette a munka a fizika.
Fizikai például: a gáz alatt a dugattyú
Klasszikus rendszer kezelendő fizika, az a gáz, az edényben található, a dugattyú alá. Mikroállapot gáz - ebben a helyzetben, és lendületet (sebesség) a minden egyes molekulák. Ez egyenértékű az a tény, hogy tudja a jelentését, hogy esett minden csontját példánkban korábban. Macrostate gáz van leírva olyan mennyiségben, nyomás, sűrűség, térfogat, a kémiai összetétel. Ez az összeg az értékeket a hengerelt kocka.
Mennyiségek leíró macrostate úgy kapcsolódhat egymáshoz egy úgynevezett „állapotegyenlet”. A jelenléte a kapcsolat lehetővé teszi, nem tudta mikroállapotok megjósolni, hogy mi fog történni, hogy a rendszer, ha elkezd ki hő vagy mozgatja a dugattyút. Egy ideális gáz állapotegyenlet egyszerű:
Bár valószínűleg jobban ismeri a Clapeyron - Mengyelejev pV = νRT - ez ugyanaz egyenlet, azzal a kiegészítéssel, egy pár állandók, hogy megzavarja te. Minél több mikroállapotok megfelel egy adott macrostate, azaz minél több részecske része a rendszer, annál jobb az állapota az egyenlet írja le. A jellemző értékek számának a gáz részecskék az Avogadro-szám, azaz a sorrendben október 23-i.
Nyomás értékek típusa, a hőmérséklet és a sűrűség az úgynevezett átlagoljuk, mint amelyek az átlagolt megnyilvánulása folyamatosan egymást követő mikroállamok ennek megfelelő macrostate (vagy inkább közel hozzá macrostates). Ha szeretné megtudni, mikroállapot, amelyben a rendszer található, van egy csomó információt - tudnunk kell, hogy a helyzetét és sebességét az egyes részecskék. Az összeg az információkat nevezzük entrópia.
Hogyan működik a változás a entrópiája macrostate? Ez könnyen érthető. Például, ha van egy kis hőt a gáz, ez növeli a sebességet a részecskék ezért növeli a mértéke a tudatlanság a sebesség, vagyis az entrópia növekszik. Vagy, ha növeljük a gáz mennyisége, nyomja a dugattyút, hogy növelje a mértéke a tudatlanság az álláspontok a részecskék és az entrópia is nőnek.
Szilárd anyagok és helyzeti energia
Ha figyelembe vesszük helyett gáz bármilyen szilárd test, különösen a rendezett struktúra kristályok, például, egy darab fém, a entrópia alacsony. Miért? Mivel tudta, a helyzet az atomok egy ilyen szerkezet, és tudod, hogy a helyzet az összes többi (úgy sorakoznak a megfelelő kristályszerkezet), a sebesség az atomok kicsi, mert nem tudnak elrepülni a helyzetüket, és csak kis mértékben ingadoznak körül az egyensúlyi helyzet.
Ha egy darab fém található a gravitációs mezőben (például, fölé a felület), a potenciális energia az egyes atom a fém megközelítőleg egyenlő a potenciális energia más atomok, és ezzel kapcsolatos alacsony entrópia energiát. Ez különbözteti meg a potenciális energia kinetikus energia, amely a termikus mozgás változhat atom atom.
Ha egy fémdarab felvetett egy bizonyos magasságban, elengedni, akkor a potenciális energia alakul át mozgási energia, de az entrópia növekszik szinte nem, mert minden atom mozog megközelítőleg azonos. De amikor egy darab a földre esik, az ütközés során a fém atomok kap egy véletlenszerű irányba, és az entrópia megemelkedik. A mozgási energia az irányított mozgás bemegy a kinetikus energia hőmozgást. Mielőtt elérünk némi tudni, hogy az egyes atom mozog, most már elvesztette ezt az információt.
Tisztában vagyunk a termodinamika második törvénye
A termodinamika második törvénye kimondja, hogy az entrópia (zárt rendszer) mindig növekszik. Most már értem, hogy miért: mert nem tud hirtelen minél több információt mikroállapotok. Amint elveszíti néhány információt mikroállapot (mind az ütközés során egy darab fém a földön), akkor nem hozza vissza.

Térjünk vissza a kocka. Emlékezzünk vissza, hogy a macrostate az összeg 59 nagyon alacsony entrópia, hanem kap ez nem is olyan egyszerű. Ha dobja a kockát, újra és újra, akkor esik ki az összegeket (macrostate), amelyek megfelelnek a nagyobb számú mikroállapotok hogy végre kell hajtani a nagy macrostate entrópia. A legnagyobb entrópia összesen 35, és hogy fog esni, mint mások. Ez róla, és azt mondta, a termodinamika második törvénye. Bármilyen random (ellenőrizetlen) kölcsönhatás növekedéséhez vezet az entrópia, legalábbis addig, amíg el nem éri a maximumot.
keverése gázok
És még egy példa, hogy rögzítse mondta. Tegyük fel, hogy van egy tartály, amelyben van két gáz, elválasztva egy válaszfal közepén helyezkedik el a tartály. Nevezzük egyetlen gázmolekulának kék, a másik - piros.
Ha megnyitja a partíció, gáz kezd keveredni, mert a több mikroállapotok amelyben a gázok keverednek, sokkal több, mint a mikroállamok ahol vannak elválasztva, és minden mikroállamok természetesen egyaránt. Amikor kinyitotta a partíciót, amit elvesztettünk az információt, hogy melyik oldalon a partíció most minden molekulára. Ha molekulák voltak N, N elvesztette az információs bitek (bitek vagy szimbólumok leírásban, ez valójában ugyanaz, és különböznek csak néhány konstans faktor).
Megértjük a Maxwell-démon
És végül, úgy a megoldás részeként a paradigma a híres paradoxona Maxwell démon. Hadd emlékeztessem önöket, hogy ez a következő. Engedje meg, hogy a vegyes gázok a kék és piros molekulákat. Tedd vissza partíció, miután tett benne egy kis lyuk, amelyek a növény a képzeletbeli démon. Feladata -, hogy adja át balról jobbra csak a piros és a kék jobbról balra csak. Nyilvánvaló, hogy egy idő után a gázokat újra osztani: az összes kék molekulák marad a falak, és az összes piros - a jobb oldalon.
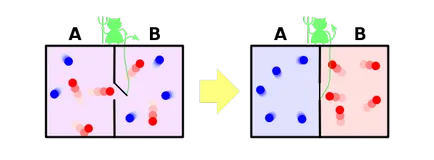
Kiderült, hogy a démon csökkentette entrópia a rendszer. Mivel nem történt semmi démon, hogy van, hogy az entrópia nem változik, de a rendszer lezárták hazánkban. Kiderült, hogy találtunk egy példát, ahol a termodinamika második törvénye nem teljesül! Amint kiderült, hogy lehetséges?
Mi megoldjuk ezt a paradoxont, de ez nagyon egyszerű. Miután entrópia - ingatlan nem a rendszer, és a tudásunk a rendszert. Mindannyian tudjuk, hogy a rendszer a kis és ezért úgy gondoljuk, hogy az entrópia csökken. De a démon tud a rendszer sok - a külön molekula, tudnia kell, hogy a pozíció és sebesség mindegyikük (legalábbis megközelíti a rá). Ha tisztában van a molekulák, hogy az ő szemszögéből, az entrópia a rendszer, sőt, nulla - nem szerepel a hiányzó információt róla. Ebben az esetben, mivel az entrópia a rendszer nem volt egyenlő a nulla és nulla marad, és a termodinamika második törvénye nem zavarják.
De még ha a démon nem tudja az összes információt a mikroállapot a rendszer, akkor legalább meg kell tudni, hogy a szín a molekula röpül rá, hogy megértsék, hogy adja át, vagy sem. És ha az összes molekula N, a démon kell N bit információt a rendszer - de ez így sok információ, és elvesztettük, amikor kinyitotta partíciót. Azaz, az információk mennyisége elveszett pontosan megegyezik azzal az összeggel, a kapott információt arról, hogy a rendszer vissza az eredeti állapotába - és ez úgy hangzik, elég logikus, és ismét nem ellentétes a termodinamika második törvénye.