Kovalens poláros és poláros kötések
Közös elektronpár előállított egyszerű anyagok 2. O 2. H Cl F 2. 2. 2. N egyformán tartozik mindkét atom. Ez az úgynevezett nem-poláris kovalens kötés.
Apoláros kovalens kötés köti össze az atomok egyszerű anyagok nem-fémek.
Ha egy kovalens kötés jön létre a különböző atomok, a teljes elektronpár eltolódik az egyik, hogy van egy nagyobb elektronegativitása (EO). Ő kap egy negatív töltéssel. Atom, amelynek kisebb EO válik a pozitív töltésű. Ebben az esetben egy poláris kovalens kötés.
Polar kovalens kötés alakul ki a nem-fémes atomok a komplex anyagok.
Tekintsük a kovalens kötések összetett anyagokat.
1. A formáció a hidrogén-klorid-molekula
A hidrogénatom a külső szinten, egy elektron. Klór külsőleg hét elektron, egy párosítatlan.
Alakult egy közös elektronpár, amely el van tolva a klóratom. Ennek eredményeképpen
részleges terhelések megjelenése: egy atom klór negatív és a hidrogénatom - pozitív. az elektronsűrűség eltolódás rendszerint jelöljük a görög betű delta δ:
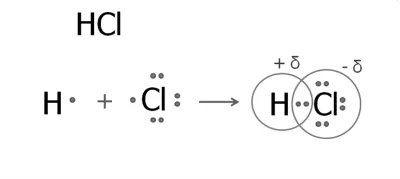
Klorid Szerkezeti képlet H - Cl.
Hasonlóképpen kapcsolódik atomok a molekulák más halogenidek:
H - F H - Br H - I
2. képződése egy vízmolekula
Külsőleg, a hat elektronok a oxigénatom, melyek közül kettő párosítatlan.
oxigénatom képez két közös elektron párokat két hidrogénatom.
Az elektronsűrűség E közös párok tolódott több elektronegatív oxigén. oxigénatom negatív töltés és a hidrogénatomok - pozitív.
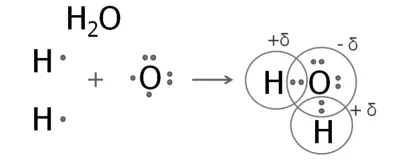
Egy hasonló szerkezet van egy hidrogén-szulfid-molekula. A szerkezeti képletek a víz és a hidrogén-szulfid:
H - O H - S | | H H
3. Az ammónia molekulák
A nitrogénatom öt külső elektronok, amelyek közül három párosítatlan.
A nitrogénatom tartja magát a három hidrogénatom.
Nitrogén - nagyobb elektronegativitású elem, így lesz egy negatív töltés atom, és hidrogénatomok - pozitív töltést.
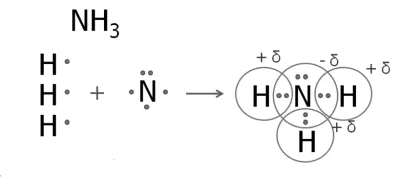
Az is elő miatt -foszfin. A szerkezeti képletek az ammónia és a foszfin:
H - N - H H - P - H | | H H
Annak érdekében, hogy meghatározzuk a részleges jelei a díjakat a atomok az anyag, meg kell összehasonlítani az EA nem-fémek.
Definiáljuk részleges díjak az atomok a vegyület C-Cl 4.
Emlékezzünk helyzetű szénatom és a klór közül az EO:
F O N Cl Br S C
A helyzet az elemek ebben a sorban azt mutatja, hogy nagyobb elektronegativitású elem van ebben a pár klór. Atom ez húzza magát általános elektron pár szénatomos. Ez azt jelenti, klóratom részlegesen negatív töltéssel egy szénatomhoz kapcsolódik, és - egy részleges pozitív:
C + δ Cl 4 - δ