Mechanizmusai szabad gyökös szubsztitúciós reakciók
A szubsztitúciós reakciót a szabad R-X R-Y az első fázisban kell lennie a szubsztrátum bomlása R-X csoportot alkot, R . amely kétféleképpen történhet:
ahol W - iniciátor.
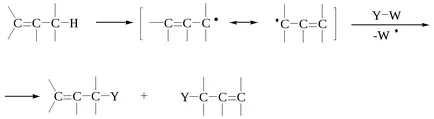
Obazom R csoport átjuthat a termék kétféle módon:
A reakciók a legtöbb termék jelenti lánchosszúság által alkotott szétválasztás (a), és nem a rekombináció (g). Lépés rasshepleniya típusú (A) jelöli SH 1, és (b) lépés és a (c) állni SH 2. A reakciókat sorolható SH SH 1 vagy 2 alapján, hogy a RX R fordul útjába (a) vagy elérési út (b).
Mechanizmusok reakciók aromás szubsztrátumok
A reakciók, az általános rendszert, amelynek:
nincs egyszerű szétválasztása rendszer proton:
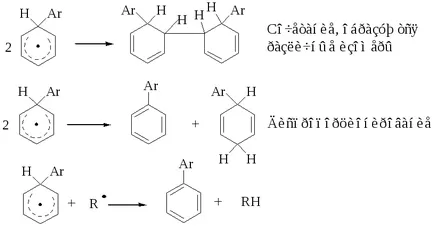
Oktatási biarilok leírja a mechanizmus magában foglalja a köztitermék kialakulásán stabilizált rezonancia:
Intermedier viszonylag stabil, és a reakciót leállítjuk, három módon:
Részvétel szomszédos csoport a szabad gyökös reakciók
Kimutatták, hogy bizonyos esetekben a hasítási lépést és az elválasztási lépés felgyorsulnak jelenlétében szomszédos csoportok. Fotolítikus halogénezés jellemzően eredményezi a termék-keveréket, azonban a brómozást a szénlánc, amelyben olyan brómatom már akkor bekövetkezik a nagy regioszelektivitással. Amikor brómozása alkil-bromidok a szubsztitúció megy végbe, a szomszédos helyzetben brómmal által 85-95%.
A szokatlanul nagy regioszelektivitással magyarázata a következő feltételezhető mechanizmusa:
Jellemzően Br elválasztja hidrogénatom R-H, amely R csoport . Ha egy megfelelő helyzetben a molekula már jelen atom Br, ez elősegíti az elválasztási eljárás, amely egy gyűrűs közbenső. Az utolsó szakaszban a ciklus megszakad. Ha ez a mechanizmus helyes, akkor a szénatom konfigurációja el kell menteni, hogy a ténylegesen megfigyelt. Elősegítő hatását a szomszédos csoportok megtalálhatók más gyökös szubsztitúciós.
Reaktivitás gyökös szubsztitúciós
A láncreakció lépésben, hogy meghatározza, hogy mely terméket kell kialakítva, gyakran egy elválasztási lépésbe. Az intézkedés alapján a radikális soha családi három- vagy négy vegyértékű atom kivételével reakciókban intenzív rendszerek, és csak ritkán jön ki a két vegyértékű atom. Mint általában, van egy szétválasztása a monovalens atom. Általában ez egy proton vagy egy halogénatom. Például, a reakciót az etán egy gyökös Cl képződött nem hidrogénatom és etilcsoport
Ennek fő oka - a térbeli. Monovalens atom sokkal nyitottabb támadni bejövő radikálisabb, mint többértékű atom. A másik ok az, hogy sok esetben a különbség vegyértékű atom energetikailag kedvezőbb.
Alkánok. A alkánok alatt szinte minden gyökök elsősorban le egy tercier hidrogénatom, akkor a másodlagos. A preferencia mértékétől függ a gyök szelektivitást és a hőmérséklet.
Hatás szelektivitás lehet tekinteni például gyökök és F Br . az elsődleges és a másodlagos helyzetben, hogy az első csere arány 1. 1,4, és a kevésbé reakcióképes Br - 1. 16000.
A természet szelektivitás változhat, ha kiszabott sztérikus faktorok. Például, a fotokémiai klóro izopentán kénsavban az intézkedés alapján N-klór-di-terc-butil-amino- és N-klór-terc-butil-terc -pentilamina elsődleges proton elválasztja 1,7-szer gyorsabban tercier. Ebben az esetben, az ion-csoport R2 + N H elég nagy ahhoz, hogy hozzon létre egy szterikus gátlást.
Olefinek. A kezelést klórral vagy brómmal szubsztrátok tartalmazó többszörös kötés általában akkor fordul elő csere és rögzítését.
Ebben az esetben van leválása egy proton, szinte soha nem figyelték szétválasztása vinil hidrogénatomok, mivel az allil-proton le egy sokkal egyszerűbb, mint más részein a molekula. Ezekben az esetekben, van egy allil átrendeződés.
Az alkil. oldallánc hiba történik túlnyomórészt -helyzetben a gyűrűhöz képest. Ez ugyanabban a helyzetben megtámadja mind aktív és szelektív gyökök.
Tartalmazó vegyületek elektronszívó csoportok. Amikor halogénezés szignifikánsan elektronszívó csoportok kikapcsolása a szomszédos helyzetben. Így típusú vegyületek Z-CH2-CH3 alá kizárólag vagy főként, hogy megtámadják -helyzetben. Vegyületek, mint például CH3COOH, nem kerülnek gyökös szubsztitúciós, szemben a elektrofil, ahol a szubsztitúció előnyösen -helyzetben. Ez azzal magyarázható, az alábbi tényezők. Mint ismeretes, magszemcsék osztatlan elektronpárt, van egy nukleofil tulajdonságok, részecskék egy üres orbitális alacsony energia, - elektrofilek. A gyökök is rendelkeznek nukleofil vagy elektrofil tulajdonságokkal tulajdonságaitól függően az elektron-atom viselő párosítatlan elektront. Halogénatomok a elektrofil csoportok, és keres helyzetben egy nagy elektronsűrűség. Az alkil-gyökök, ezzel szemben mutatnak nukleofil tulajdonságok és képesek elvonni egy protont a csökkentett elektronsűrűség.
Példa. Helyettesítés a propionsav
jelzi, hogy a metil-támadások több -helyzetben és a Cl - -helyzetben.
Aromás szubsztrátumok. A szabad gyökös szubsztitúció az aromás szubsztrátumok csak ritkán folyik keresztül a hidrogén elválasztó mechanizmus:
Jellemzően kialakított közbenső:
A különböző tényezők hatását a reaktivitása az aromás szubsztrátumok
1. Valamennyi szubsztituens növeli a reaktivitás az orto - és para-helyzetében képest benzol, függetlenül attól, hogy elektronküldő vagy elektronszívó.
2. reaktivitás a meta-helyzetben nem függ a szubsztituens természetétől, és közel van a reakció benzol képességét.
3. Reaktivitás orto-helyzetben általában magasabb, mint a gőz - kivéve, nagy térkitöltésű csoportokat.
4. Ami a közvetlen verseny elektronszívó csoportok nagyobb hatással, mint az elektron.
5. Hatás A szubsztituensek sokkal kisebb, mint az SN és a SE reakciók.
Hatása a természet a támadó a reaktivitás a radikális
Radicals különböznek egymástól reaktivitást. Ebben az esetben több reakcióképes kevésbé szelektív, kevésbé reaktív, és sokkal szelektívebb. Minden gyökök általában semlegesek, de rendelkeznek változó mértékben elektrofil vagy nukleofil tulajdonságokat.
Hatása a természet a oldószer reaktivitásának
Rasvoritel általában csekély hatása van a szabad gyökös szubsztitúciós reakció, szemben a ionos reakciókkal. Azonban, bizonyos esetekben, az oldószer lehet egy észrevehető hatást.
Ezeket az eredményeket tulajdonítható, hogy a komplex képződését között az oldószer és a klóratom
így Cl kevésbé reaktív, és ezért szelektívebb.