Előadás 2 ctroenie atom
Structure atomok. A modern megfogalmazása a periódusos törvény.
Kvantummechanikai leírása az elektron egy atom
3 képződése az elektron héj az atom.
4-dimenzió alapvető törvények elektronok töltse szintek, sublevels és pályák a elektron héj az atom
5 E-konfigurációjú atomok és periódusos rendszer.
Structure atomok. A modern megfogalmazása a periódusos törvény.
A felfedezés a periodikus törvény előfeltétele volt, hogy a teremtés a XX században. Az elmélet az atomi szerkezetét.
1911-ben, Ernest Rutherford javasolt a nukleáris atom modell.
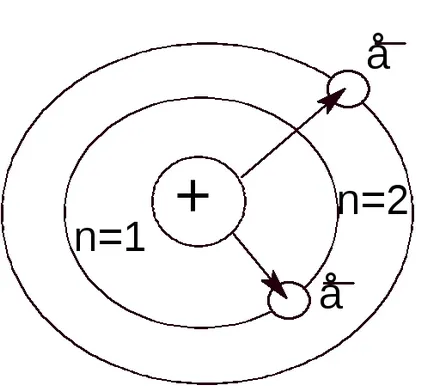
E modell szerint atom áll, egy pozitív töltésű mag és a nucleus körül keringő negatív töltésű elektronok. A fuvarozó a pozitív töltésű atommag egy proton.
A készítmény tartalmaz atommagok neutronok - elemi részecskék. amelyeknek nincs elektromos töltése.
Az elektronok száma egyenlő a felelős a sejtmagban. Egy atom egésze elektromosan semleges. A legegyszerűbb mag egy magja a hidrogénatom. a töltése +1, a relatív súlya - körülbelül 1 a. e. m. A nucleus hidrogénatom nevezték proton *. felelős a proton egyenlő nagyságú és ellentétes előjelű töltést az elektron.
A méretek megközelítőleg 10-8sm atom. Kernel méret - 10-13 10-12cm. Annak ellenére, hogy a kernel méretének a több tízezer szor kisebb, mint az egész atom, a túlnyomó részét a tömeg az atom koncentrálódik a sejtmagban.
1913-ban az angol fizikus H. Moseley találtuk, hogy a nukleáris töltet számszerűen megegyezik a sorszáma az elem a periódusos rendszerben.
Így a töltés az atom magok lesz a fő jellemzője a kémiai elem.
Ebből következik a modern megfogalmazása a batch-Kona -
A tulajdonságait az elemek és a tulajdonságok alkotnak egyszerű és komplex anyagokat periodikusan töltésétől függően a magok az atomok.
Moseley vizsgálatok megerősítették a helyességét a helyen, a periódusos rendszer elemeinek, amelyek alapján az értékek azok atomtömege, voltak „pozíción kívül”: A argon (Ar = 39,9), mielőtt a kálium (Ar = 39,1), kobalt (Co = 58,9), hogy a nikkel (Ni = 58,7), és a tellúr (Te = 127,6) a jód (I = 126,9). Összhangban a nagysága a töltés-E mag, ezek az elemek kerültek a megfelelő Mengyelejev rendszer.
Kvantummechanikai leírása az elektron egy atom
1900-ban G. M. Plank megmagyarázni a viselkedését az elektron egy atom kvantum javasolta a hipotézist, hogy az energia a elektronok egy atom is bocsátanak ki, vagy elnyelik csak meghatározott részei - kvantumokat.
1913-ban, Niels Bohr használta a kvantumelméletet megmagyarázni, a spektrum atomos hidrogén az a feltételezés, hogy az elektronok a atomok csak bizonyos „megengedett” kering, amelyek megfelelnek bizonyos energia értékeket. Bohr azt javasolta, hogy mivel ezek a pályák, az elektron nem sugároz energiát addig. miközben nem teszi az átmenet az egyik pályáról a másikra.
Bohr van pontosan kiszámítani a frekvenciaspektrumai hidrogénatom, és a másik egy-elektron rendszerek, azaz. E. ionok, például hélium, lítium, berillium.
Azonban, az átmenetet a bonyolultabb elektronikus rendszerek - sok-elektron - Bohr volt elegendő.
Szükség volt egy általánosabb elmélet, az úgynevezett kvantum mechanika. Egy ilyen elmélet viselkedésének leírására az elektron egy atom.
Azokban az években 1923-1927 kerültek megfogalmazásra az alapelveket a kvantummechanika.
A kvantummechanikai elmélet két fő rendelkezéseit.
Egy elektron kettős természete van. Azt a tulajdonságai mind a részecskék és a hullámok egyszerre.
Electron, mint egy részecske tömegét és töltését. Azonban, a mozgás az elektronok - egy hullám folyamat. Elektronok jellemző diffrakciós jelenségek-állítva (ez azt jelenti, hogy az elektronok áramlását akadályok körül).
helyzetben az elektron egy atom bizonytalan.
Ez átalakítja-chaet, lehetetlen, hogy egyszerre és pontosan meghatározni a sebességet az elektron és a koordinátái az űrben.
Elektronikus ami mozog nagy sebességgel, lehet bármely része a tér az atommag körül, és a pillanatnyi pozícióját más formában az úgynevezett cloud sneravnomernoy moeelektronnoe sűrűségű negatív-negatív töltés (3.1 ábra).
Az alakja és mérete az elektron felhő eltérő lehet attól függően, hogy az elektron energia.
A kémiai jellemzőit az elem, amely állapota határozza meg az elektronok az elektron héj a atom szükséges tudni:
- energia az elektron az atom (pontosabban, az energia a rendszer, CO-Állandó ezen elektron, egyéb elektronok és a magból;
- az alak a elektron felhő adatok generált elektron.

Az elektron állapotok az atom leírható négy kvantumszámok: fő, orbitális, és mágneses spin.
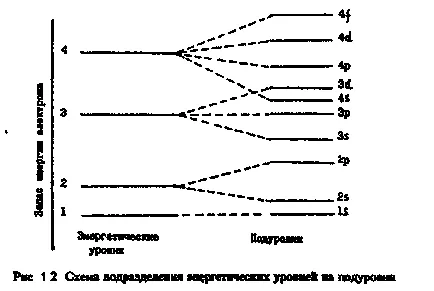
Attól függően, hogy az energia a elektronok az atom elkülönített energia resou-cal szintek és sublevels.
A főkvantumszám (n) pont jelenti az energia szinten, és határozza meg a méret az elektron felhő, t. E. Az átlagos távolsága az elektron a sejtmagban.
A főkvantumszám jelentése egész szám 1, 2, 3 n, amelyek megfelelnek a számát az energia-urs nemkívánatos.
A nagyobb n értéke, annál nagyobb az elektron energia, így minimális energia megfelel az első szinten (n = 1). A magasabb értékek n megfelelnek az magasabb értékeket elektron energia. Minél nagyobb az energiája az elektron, annál eltávolítjuk ő a sejtmagban.
Nagy értéke a fő kvantum száma megegyezik a nagyobb méretű az elektron felhő. Az elektronok, amelyeket az jellemez, ugyanazt az értéket a fő kvantum n szám, az elektron felhők képződött hozzávetőleg azonos méretű.
Vagy oldalsó orbitális kvantumszámmal (L) Character-zuet energia szintalatti alakját meghatározó az elektron-felhő
Orbitalnoeilipobochnoe kvantum szám (L) egy egész szám 0-tól (n - 1). Értékét általában nevezik számokkal és betűkkel:
A lehetséges értékek számát az L megfelel a számos lehetséges sublevels ezen a szinten egyenlő a szint száma (n).
A 5,6,7 energia szintet, valamint a 4 lehet elhelyezve az elektron 32 (5S, 5p, 5d, 5f)
Alapvető törvényei dimenzió-töltés elektronok szintek, sublevels és pályák a elektron héj az atom
Töltési szint elektronok, sublevels és pályák a elektron héj az atom-határozza meg a következő jogi dimenzió:
I- elve minimális energia: a steady-state elektron-trónok vannak a legalacsonyabb energiaszint és sublevels.
Ez azt jelenti, hogy minden egyes új elektron belép az atom a legkisebb (az energia) szintalatti szabadon. A set-goelektronnogo energia pályák atomok szinteken és sublevels-Nyah a következőképpen változik: 1s <2 s <2р <З s <Зр <4 s <3d <4р <5 s <4d <5р <6s <4f ≈ 5d <6p <7s <5f ≈6d <7p .
Töltési sorrend atomi pályák, attól függően, hogy az értékek a megbízó és orbitális kvantum meghatározott számok szabályok Klechkovskii:
növelésével a töltés az atommag szekvenciális feltöltését atomi pályák elektronokkal a pályák történik kisebb nagyságrendű tőkeösszeg és orbitális kvantum számok (n + l) a pályák egy nagy értékű ez az összeg;
2), amely azonos értékek összege (n + l) pálya a töltés úgy történik irányába növekvő értékek az főkvantumszám n (1.2 táblázat).
1.2 táblázat - A sorrend töltési atomi
Így, bár a 3D-orbitális elem szerepel már a harmadik időszakban, 3d-pályák a töltés úgy történik csak a töltés után a 4s-pályák, azaz elemek a negyedik periódusban.
III- Pauli-elv: az atom nem lehet két elektron ugyanazokat az értékeket a négy kvantumszám.
Minden orbitális - egy energia állapotban, amely jellemzi az értékek három kvantumszámok: N, liml. Ezek a számok határozzák meg a mérete, alakja és tájolása orbitális tér. Ezért, az egyik orbitális nem lehet több, mint két elektron, és ők változik a Th-értékhez-forog (spin) quantum száma: TS = +1/2 vagy - 1/2
IV-Hund szabály: a maximális számú elektron töltse álló pályák hogy a több párosítatlan elektronok volt a legnagyobb képződése során az elektronikus sublevels.
Atom stabil állapot megfelel egy elektronok eloszlását belüli alréteg, ahol az abszolút értéke a maximális teljes centrifugálás (Hund szabály). Ezért, amikor rends orbitáijaihoz szénatomot és nitrogén- megtölti minden egyes elektron orbitális a szabad, nem párosítva másik elektron.
A szerkezet az elektron héj az atom és a helyzet-MENT elemek a periódusos rendszerben vannak összekapcsolva. Ismerve bomlás-elem a periódusos rendszerben, lehetőség van, hogy meghatározza a szerkezet a elektron héj egy atomja bármely elemét.
A sorszám az elem a periódusos rendszerben a felelős bizonyítja atommag és az elektronok száma az atom.
időszakban megfelelő számot száma energiaszintek az elektron héj atomok összes eleme egy adott időszakban.
Csoport száma általában megfelel a számát vegyérték elektronok az atomok az elemek a csoportban.
Vegyérték elektronok - az elektronok a legújabb energia-matic szinten. Vegyérték elektronok van egy maximális energia, és részt vesznek a kialakulása közötti kémiai kötések atomok molekulák.
A atomjai elemek fő csoport (A) az összes vegyérték elektronok vannak utolsó energia szinten, és a számuk egyenlő a csoport szám.
Az oldalsó elemei alcsoportok atomok (B) a végső energia szinten nahoditsyane egy két elektron, oc-tal vegyérték elektronok napredposlednemener-energiaszintet. A teljes száma vegyérték elektronok, mint általában, egyenlő a csoport szám.
A száma töltött elektron energia szintek egy atom szám megfelel az időszakban, amelyben az elem-MENT: az atomok az elemek I időszakban - az egyik az energia szinten, a atomok II időszakban - két, stb
A legnagyobb elektronok száma energiaszinten egyenlő:
ahol n - száma a szinten, vagy a főkvantumszámú.
Ezért, az első energiaszint lehet locat-ditsya nem több, mint két elektron, a második - nem több, mint 8, a harmadik -nem több mint 18, a negyedik - nem több, mint 32.
Most tekintsük a szerkezet egy elektron szinten. Kezdve a értéke n = 2 energiaszintek megszemélyesíteni-elosztjuk alrétegek, hogy különböznek egymástól miatt az energia a sejtmagban. A számos al-szintek egyenlő a fő Kwan-tovogo számot, de nem haladja meg a négyet.
H
Az elektron eloszlás által szintek és sublevels (elekt-nikus konfigurációja atomok) van rögzítve, mint az elektron-CIÓ képletek.
Például, e képlet a nátrium-atom van írva, mint:
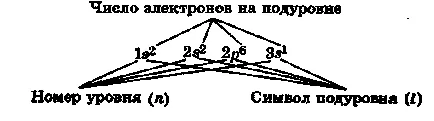
Az elektronikus konfigurációja az atomok és a periódusos rendszerben.
Elektronikus atom konfigurációja - a forgalmazás minden atomok elektronjainak a szintek, sublevels és pályák.
Vannak 2 módon leírni az elektron konfiguráció:
1 - Elektronikus képletű
2- elektron-grafikus konfiguráció.
A tipikus atomi alapállapot (minimum energia), illetve nyugalmi állapotban és gerjesztett állapotban.
Elemei az első időszakban (H, He)
A sorszám a periódusos elem ravenzaryadu nucleus atom Z, és így iobschemu elektronok száma az atom.
A legstabilabb (gerjesztett) elektron egy atom állapotban megfelel a minimális lehetséges értéke az energia az elektron.
Bármely más állam izgatott; belőle spontán megy az elektron állapotát alacsonyabb energia.
A gerjesztett hidrogénatom (Z = 1) csak az elektron a lehető legalacsonyabb energia szint: n = 1. Ebben az esetben, az orbitális kvantum is igénybe vehet, csak egy érték L = 0. Tehát, az első energiaszint van kialakítva csak az S-orbitális, és ahol az elektron.
Electron folyamatábra hidrogénatom:
Elektronikus képletű hidrogénatom: 1s 1.
A hélium atom (Z = 2), a második elektron szintén található a 1s orbitális. Elektronikus képlete hélium atom: 1s 2.
Electron folyamatábra héliumatom:
Elemei a második időszak (Li - Ne)
A következő hélium elem - lítium (Z = 3) - harmadik elektron nem marad az első energia szinten, mint az egyik orbitális nem lehet több, mint két elektront. Ezért a harmadik elektron kell elhelyezni a második energiaszint n = 2.
Ha n = 2 az orbitális kvantumszámmal vehet két érték: L = 0; 1. Így a második energiaszintre van kialakítva pályák két típusa van: az egyik s-orbitális és három p-pályák.