Kemény és lágy savak és bázisok
Fogalmai kemény és lágy savak és bázisok, RJ Pearson
Jelenleg használt fogalmát által előterjesztett Pearson, hogy minden savak és bázisok is két csoportra oszthatók - lágy és kemény. Számukra, az igazi szabály: lágy savakkal kötődnek lágy bázisokkal, kemény sav - egy merev alap.
Lágy savak nagy és kis pozitív töltést ($ Cu ^ + $, $ Ag ^ + $, $ Au ^ + $, $ Hg ^ + $, $ Pt ^ $, $ Br_2 $, $ I_2 $ et al.) .
Kemény sav jellemzi a kis méret és a nagy pozitív töltést ($ H ^ + $, $ Mn ^ $, $ Fe ^ $, $ CO ^ $ et al.). Ők csak akkor jár, mint elektron akceptor.
Puha bázisok az erős redukálószerek ($ H ^ - $, $ I ^ - $, $ S ^ $, $ CO $, $ R_2S $ et al.).
Merev bázisok az erős oxidáló szerekkel ($ F ^ - $, $ Cl ^ - $, $ OH ^ - $, $ NH_3 $, $ H_2O $ et al.).
Ahhoz, hogy a közbenső savak kétszeresen $ d $ - ionok ($ Fe ^ $, $ CO ^ $, $ Ni ^ $ et al.) És a közbenső bázisok ($ Br ^ - $, $ SO_3 ^ $ et al.).
Megkülönböztető tulajdonságok kemény és lágy savak és bázisok
A koncepció a kemény és lágy nem azonos fogalmak az erős és gyenge.
És példák a legfontosabb jellemzői a kemény és lágy savakat és bázisokat táblázatban felsorolt
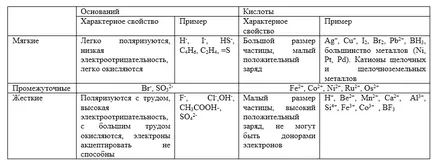
Abból a szempontból a kemény és lágy savak elmélet a következő reakciók:
Reakciók társított elektrontranszfer
$ H_3O ^ + + NH_3> H_2O + NH ^ $
Addíciós reakció vegyületeket nyerjük (a reakció a sav és a bázis általános formában .:
A nukleofil szubsztitúciót. Részecske - nukleofil (anion vagy molekula) $ B: `$ hordoz magányos elektronpár, ami miatt egy új kötést. $ AB $ molekula megy nukleofil támadás, $: B $ jelentése kilépő csoport.
Elektrofil szubsztitúció. Elektrofil ügynök, hiányos elektronhéjak és hajlamos kitölteni őket. Molecule $ BA $ tapasztalható támadás az elektrofil.
Kommunikáció erős savakat, egy merev alap miatt ionerősség. Lágy kötődnek lágy sav-bázis kovalens kötéssel. A kovalens kötés elég erős volt, az szükséges, hogy az atomok voltak hasonló méretű és elektronegativitás értékek.
Széles körben használják a gyakorlati célokra:
Ez megmagyarázza, hogy miért a természetben fordul elő, mint az alumínium-oxid, hidroxid és szilikát, réz, higany - szulfid formájában, kalcium - mint karbonát. Fémek átmeneti csoport VIII elemeket lágy savak katalizálják reakciókat tartalmaznak, amelyek enyhe bázis (szén-monoxid). Lágyabb bázis (a vegyület arzén és a foszfor) katalitikus mérgek mert képeznek stabil vegyületek ezekkel a fémekkel és blokkolják az aktív centrumban.
Ez magyarázza a mérgező szén-monoxid az emberre. Szén-dioxid képez stabilabb vegyületet, mint az oxigén hemoglobin vas.
Hasonlóképpen, a szén-monoxid olyan nehézfém-ionokat ($ Pb ^, Hg ^ $), amelyek kölcsönhatásba lépnek a $ SH $ - élettanilag fontos vegyületcsoportot letilthatja a funkciójukat.