rácsok
Az anyag, mint tudjuk, létezhet három állam: gáz, folyékony és szilárd. Például, az oxigén. amelyek normál körülmények között egy gáz hőmérséklete -194 ° C hőmérsékleten folyékony, kék színűvé, I hőmérsékleten -218,8º C hó-megszilárdult anyag, amely kék kristályok.
Ebben a részben megnézzük, milyen jellemzői befolyásolják a kémiai kötések a tulajdonságait szilárd. A hőmérséklet-tartomány a létezés anyagok a szilárd állapotban határozza meg annak olvadás- és forráspontja. A szilárd anyagot esnek kristályos és amorf.
Amorf anyagok nem egyértelmű olvadáspontja - melegítéssel meglágyult, és fokozatosan adja át a folyékony állapotban. Az amorf állapot, például, ez az agyag vagy különböző gyantákat.
Kristályos anyagok azzal jellemezhetők egy szabályos elrendezésben a részecskék, amelyek állnak: az atomok, molekulák és ionok. - szigorúan meghatározott térbeli pont. Csatlakoztatja ezeket a pontokat egyenesekkel alkot térbeli keret, amely az úgynevezett rács. A pontok, ahol a részecske kristályrács nevű meghatározott.
A csomópontok lehetnek képzeletbeli rács ionok, atomok és molekulák. Ezek a részecskék oszcillálnak. Növekvő hőmérséklettel a körét ezek a rezgések növeli, amely általában vezet hőtágulás a szervek.
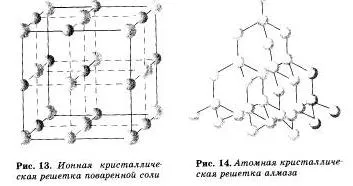
Attól függően, hogy milyen típusú részecske elhelyezve kristályrácsban, és a természet a kapcsolat közöttük négyféle kristályrétegeiben: ionos, atomi, molekuláris és fém (6. táblázat).
Egyszerű anyagok más elemek nem a 6. táblázatban felsorolt a fémrács.
Úgynevezett ionos rácsok, amelyben az ionok csomópontok. Ezek az anyagok ionos kötést, amely lehet csatlakoztatni mind egyszerű, ionok Na +, Cl- és SO 2- 4 komplex, OH. Ezért, ionos sók kristályrácsban, néhány fém-oxidok és -hidroxidok. azaz ezek az anyagok, ahol ionos kémiai kötés. Például, a kristály nátrium-klorid van felépítve váltakozó pozitív ionok a Na + és Cl- negatív képező rács a kocka alakú. Közötti kommunikáció az ionokat egy kristály nagyon stabil. Így azon szerek, ion reshetnoj viszonylag nagy keménység és tartósság, ezek tűzálló és nem illékony.
Öntött atomi kristályrács, a csomópontok, amelyek az egyes atomok. Az ilyen rácsok-atomot tartalmaznak, összekötve nagyon erős a kovalens kötés. Példák anyagok ilyen típusú kristályrétegeiben lehet gyémánt - a szénatomok egyike allotropic módosításokat.

Az anyagok száma a atomrácshibák nem túl nagy. Ezek közé tartoznak a kristályos bór, szilícium és germánium, és komplex anyagokat, például olyanokat, amelyek közé tartozik a szilícium-oxid (IV) - SlO2: szilícium, kvarc, homok, hegyikristály.
A legtöbb vegyületet egy atomi kristályrács igen magas olvadásponttal (például egy gyémánt mint 3500 ° C), ezek erős és kemény, szinte oldhatatlan.
Úgynevezett molekularács, amelyek székhelye a csomópontok a molekula. A kémiai kötés Ezek a molekulák lehetnek poláros és nem poláros. Annak ellenére, hogy az atomok a molekulák kovalens kötések nagyon erős. a molekulák között maguk gyenge erők mozhmolekulyarno az első vonzás. Következésképpen azok a hatóanyagok molekuláris rácsok alacsony keménység, alacsony olvadáspontú, az illékony.
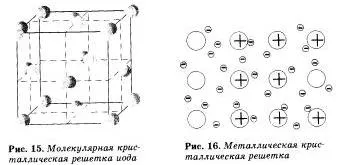
Példák anyagok molekuláris rácsok szilárd vizet - jéggel, szilárd szén-oxid (IV) - «szárazjég”, szilárd hidrogén-szulfid és hidrogén-klorid, egyszerű szilárd anyagok által alkotott on- (nemesgázok), kétszer. három (O3), négy (P4). vosmiatomnymi molekulák. A legtöbb szilárd szerves vegyületek molekularács (naftalin, glükóz, cukor).
Anyagok fémes kötéssel van fém kristályrácsban. A csomópontok ilyen rácsok olyan atomok és ionok (atomok, hogy az ionok könnyen átalakíthatjuk a fém atomok, így a külső elektronok közös használatra). Az ilyen fémek belső szerkezetét, hogy meghatározza a jellemző fizikai tulajdonságai: alakíthatóság, plaszticitás, elektromos és hővezető, jellegzetes fémes csillogás.
Azon anyagok, amelynek a molekulaszerkezete, csak nyissa meg a francia kémikus JL Proust (1799-1803) törvénye állandó összetételű. Jelenleg ez a törvény az alábbiak szerint történik: „A molekulájú kémiai vegyületeket, függetlenül azok előállítási eljárást egy állandó összetételű és tulajdonságú. Proust jog egyik alapvető kémiai törvényekkel. Azonban az anyagok nsmolekulyarnym szerkezet, mint például egy ion, ez a törvény nem mindig igazságos.
1. Szilárd, folyékony és gáznemű halmazállapot.
2. Szilárdanyag: amorf és kristályos.
3. kristályrács: atomic, ionos és molekuláris fém.
4. A törvény a határozott arányok.
Milyen tulajdonságokkal naftalin van alapja annak alkalmazási védelmére gyapjúholmikat a molyok?
Mik a jellemzői kristályos és amorf anyagok hasznosak opnsaiiya jellemvonások egyének?
Miért nyílt K. X. alumínium dán tudós Oe 1825 sokáig tartozott a nemesfémek?
Gondoljunk csak a termék A. Belyaeva „eladó levegő” és írja le a tulajdonságait szilárd oxigén, a megadott leírás a könyvben.
Miért fém olvadási hőmérséklete változik nagyon széles határok között? A készítmény a válasz erre a kérdésre, akkor a további szakirodalom.
Miért van a termék szilícium ütközés során szét darabokra, és a termék a vezető csak lapított? Ezek közül néhány esetben a megsemmisítése a kémiai kötés, és amelyekben - nem? Miért?
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.