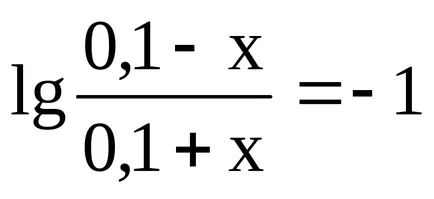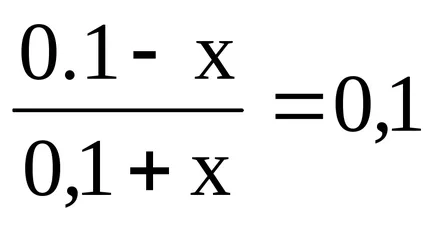Kiszámítása pH-pufferek 1
Számítsuk ki a pH-ja a pufferoldattal, amely 1 liter 0,1 M ecetsavat és 0,1 mol nátrium-acetát.
A hidrogénionok koncentrációját számítjuk a disszociációs állandója ecetsav:
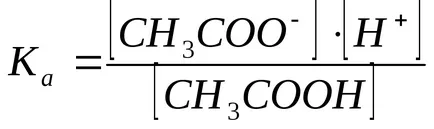
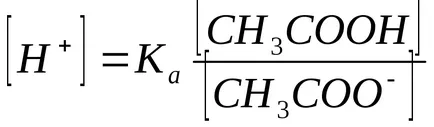
A nátrium-acetát jelenlétében egyensúlyi disszociációs acetátot balra mozog, ezért feltételezhetjük, hogy
Általánosságban, egy puffer-oldat összekeverésével állítjuk elő egy gyenge sav és sója:
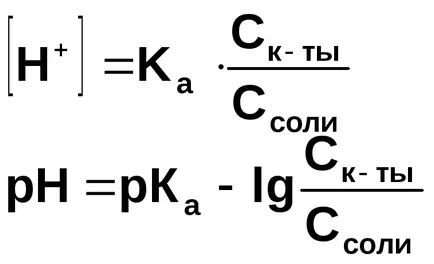
Számítsuk ki a pH-ja a pufferoldattal, amely 1 liter 0,01 mól ammónium-hidroxid és 0,1 mol ammónium-kloridot.
A koncentráció-hidroxid ion számított disszociációs állandója ammónium-hidroxid:
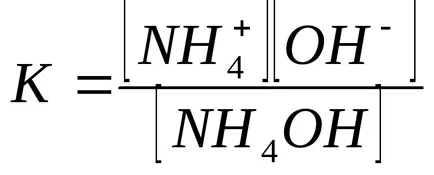
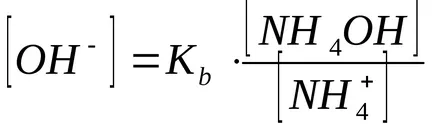
A jelen ammónium-klorid, ammónium-hidroxid disszociációs egyensúlya balra tolódik, ezért feltételezhetjük, hogy
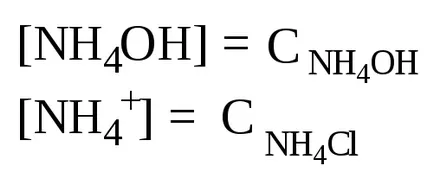
Haladva az ion terméket víz, kiszámításához [H +], és a pH-ja az oldat:
Általánosságban, a pufferelés oldatok összekeverésével állítjuk elő a gyenge bázis és sója:
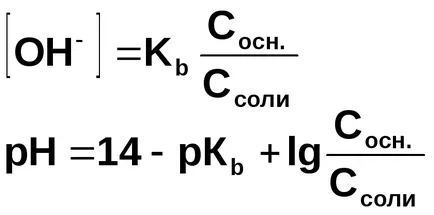
A hatásmechanizmus a puffer rendszerek
A pufferelés kereset alapul kötő puffer rendszer komponenseit érkeznek az oldatot ionok H + és OH - ionok alkotnak gyenge elektrolitok.
Kiszámítjuk hogyan kell változtatni a pH a puffer-oldat 1 liter koncentrációjával ecetsav és nátrium-acetát 0,1 mol / l, hozzáadunk: a) 0,01 molHCl; b) 0,01 molNaOH; c) hígítás hatására 10-szer.
a) Ha hozzáadjuk a puffer oldat HCI feleslegét H + ionok kötődnek acetát anion a molekulában a gyenge elektrolit ecetsav:
A koncentrációja molekuláris ecetsav, hogy növelni 0,01 mól / liter, és az acetátpuffer koncentrációja ionok csökken az azonos mennyiségű:
[CH3 COOH] = 0,1 + 0,01 = 0,11 mol / l
[CH3 COO -] = 0,1 - 0,01 = 0,09 mol / l
pH = -lg 2,1410 -5 = 4,67
Így, a pH a puffer-oldat csökkent 4,76-4,67, azaz 0.09. (Összehasonlításképpen, hozzátéve, 0,01 mol HCI 1 liter vízzel pH tartomány 7-2, azaz 5 egység).
b) Amikor a NaOH-ot adunk a puffer oldat, feleslegben lévő ionokat OH - kölcsönhatásba lép a molekulákkal ecetsav alkotnak egy gyenge elektrolit víz:
A koncentrációja molekuláris ecetsav csökken 0,01 mol / l, és az acetátpuffer koncentrációja ionok növekszik az azonos mennyiségű:
[CH3 COOH] = 0,1 - 0,01 = 0,09 mol / l
[CH3 COO -] = 0,1 + 0,01 = 0,11 mol / l
pH = -lg 1,4310 -5 = 4,84
Így, amikor a bázis hozzáadásával a pH-változás csak csekély mértékben (0,08).
c) A hígító pufferrel 10-szorosának megfelelő koncentrációban komponensek ugyancsak csökkentik 10-szer, és ha nem veszik figyelembe változásokat a disszociációs mértéke ecetsavban hígító oldattal pH nem változik:
pH = -lg 1,7510 -5 = 4,76.
Az a képesség, hogy puffer-rendszer, hogy fenntartsák a állandóságát a pH a pufferben meg van határozva, és a korlátozott kapacitása az oldat.
A puffer kapacitása egyenlő a számát ekvivalens sav, vagy lúg, hozzáadásával az oldat pH-megváltozik egy.
A puffer kapacitása függ a puffer koncentrációja komponensek és azok kapcsolatokat. Növelésével növekszik az oldat koncentrációjának és eléri a maximális érték egy azonos koncentrációjú összetevői.
Mindegyik puffer-rendszer a pH-működési tartományt, amelyen túl puffer kapacitása drasztikusan csökken. Ahhoz, hogy egy puffer oldatot, amely a gyenge sav és sója, a működési pH-tartomány belül pKa 1.
Példa. Számítsuk ki a puffer edényen tekintetében a savas oldatot tartalmazó 1 liter 0,1 mólos ammónium-hidroxid és 0,1 mol ammónium-kloridot.
pH A betáplált oldat kiszámítani:
Legyen a puffer kapacitása az oldat sav x. Így X - a száma mól sav is adunk az oldathoz, hogy a pH csökken az egyik, azaz Ez volt egyenlő 8,26.
Amikor adunk x mol HCI-oldattal reakció lép fel:
Így NH4 OH koncentráció csökken (0,1 - x), és NH4 + koncentráció emelkedik (0,1 + x). Behelyettesítve ezeket a kifejezéseket a képletet a oldat pH-ja, ezt kapjuk: